Величина заряда дана в кулонах, масса — в килограммах (единицах СИ); слова «спин» и «статистика» будут пояснены ниже.
Обратим внимание на различие в массе частиц: протоны и нейтроны почти в 2000 раз тяжелее электронов. Следовательно, масса любого тела почти целиком определяется массой протонов и нейтронов.
Нейтрон, как это следует из его названия, нейтрален — его заряд равен нулю. А протон и электрон имеют одинаковые по величине, но противоположные по знаку заряды. Электрон заряжен отрицательно, а протон — положительно.
Среди характеристик частиц нет, казалось бы, важной характеристики — их размера. Описывая строение атомов и молекул, электроны, протоны и нейтроны можно считать материальными точками. О размерах протона и нейтрона придется вспомнить только при описании атомных ядер. Даже по сравнению с размерами атомов протоны и нейтроны чудовищно малы (порядка 10 -16 метра).
По сути дела, этот короткий раздел сводится к представлению электронов, протонов и нейтронов как строительного материала всех тел в природе. Можно было бы просто ограничиться таблицей 1, однако нам предстоит понять, каким образом из электронов, протонов и нейтроновосуществляется постройка, что заставляет частицы объединяться в более сложные конструкции и каковы эти конструкции .
АТОМ — НАИБОЛЕЕ ПРОСТАЯ ИЗ СЛОЖНЫХ КОНСТРУКЦИЙ
Атомов много. Оказалось необходимым и возможным упорядочить их специальным образом. Упорядочение дает возможность подчеркнуть различие и сходство атомов. Разумное расположение атомов — заслуга Д. И. Менделеева (1834-1907), который сформулировал периодический закон, носящий его имя. Если временно отвлечься от существования периодов, то принцип расположения элементов крайне прост: они располагаются последовательно по весу атомов. Самый легкий — атом водорода. Последний природный (не созданный искусственно) атом — атом урана, который тяжелее его в 200 с лишним раз.
Понимание строения атомов объяснило наличие периодичности в свойствах элементов.
В самом начале XX века Э. Резерфорд (1871-1937) убедительно показал, что почти вся масса атома сосредоточена в его ядре — небольшой (даже по сравнению с атомом) области пространства: радиус ядра приблизительно в 100 тысяч раз меньше размера атома. Когда Резерфорд производил свои эксперименты, еще не был открыт нейтрон. С открытием нейтрона было понято, что ядра состоят из протонов и нейтронов, а атом естественно представлять себе как ядро, окруженное электронами, число которых равно числу протонов в ядре — ведь в целом атом нейтрален. Протоны и нейтроны, как строительныйматериал ядра, получили общее название — нуклоны(с латинского nucleus — ядро). Этим названием мы и будем пользоваться.
Количество нуклонов в ядре принято обозначать буквой А. Ясно, что А = N + Z, где N — число нейтронов в ядре, а Z — число протонов, равное числу электронов в атоме. Число А носит название атомной массы, а Z — атомного номера. Атомы с одинаковыми атомными номерами называют изотопами: в таблице Менделеева они находятся в одной клеточке (по-гречески изос — равный, топос — место). Дело в том, что химические свойства изотопов почти тождественны. Если таблицу Менделеева рассмотреть внимательно, можно убедиться, что, строго говоря, расположение элементов соответствует не атомной массе, а атомному номеру. Если элементов около 100, то изотопов более 2000. Правда, многие из них неустойчивы, то есть радиоактивны (от латинского radio — излучаю, activus — деятельный), они распадаются, испуская различные излучения.
Урок 470. Открытие нейтрона. Протонно-нейтронная модель ядра
Опыты Резерфорда не только привели к открытию атомных ядер, но и показали, что в атоме действуют те же электростатические силы, которые отталкивают друг от друга одноименно заряженные тела и притягивают друг к другу разноименно заряженные (например, шарики электроскопа).
Атом устойчив. Следовательно, электроны в атоме движутся вокруг ядра: центробежная сила компенсирует силу притяжения. Понимание этого привело к созданию планетарной модели атома, в которой ядро — Солнце, а электроны — планеты (с точки зрения классической физики, планетарная модель непоследовательна, но об этом ниже).
Есть целый ряд способов оценить размер атома. Разные оценки приводят к близким результатам: размеры атомов, конечно, различны, но приблизительно равны нескольким десятым нанометра (1 нм = 10 -9 м).
Рассмотрим для начала систему электронов атома.
В Солнечной системе планеты притягиваются к Солнцу силой гравитации. В атоме действует электростатическая сила. Ее часто называют кулоновской в честь Шарля Огюстена Кулона (1736-1806), установившего, что сила взаимодействия между двумя зарядами обратно пропорциональна квадрату расстояния между ними. Тот факт, что два заряда Q1 и Q2 притягиваются или отталкивают ся с силой, равной FC = Q1Q2/r 2 , где r — расстояние между зарядами, носит название «Закон Кулона». Индекс «С» присвоен силе F по первой букве фамилии Кулона (по-французски Coulomb ). Среди самых различных утверждений мало найдется таких, которые столь же справедливо названы законом, как закон Кулона: ведь область его применимости практически не ограничена. Заряженные тела, каких бы они ни были размеров, а также атомные и даже субатомные заряженные частицы — все они притягиваются или отталкиваются в согласии с законом К
Fatal error: Uncaught Error: Call to undefined function set_magic_quotes_runtime() in /www/htdocs/1dbcf2b3552b065fc49d8747114db86c/sape.php:262 Stack trace: #0 /www/htdocs/1dbcf2b3552b065fc49d8747114db86c/sape.php(343): SAPE_base->_read(‘/www/htdocs/1db. ‘) #1 /www/htdocs/1dbcf2b3552b065fc49d8747114db86c/sape.php(418): SAPE_base->load_data() #2 /www/htdocs/links.html(7): SAPE_client->SAPE_client() #3 /www/htdocs/happy_physics/kaganov4.html(128): include(‘/www/htdocs/lin. ‘) #4 thrown in /www/htdocs/1dbcf2b3552b065fc49d8747114db86c/sape.php on line 262
Кем и когда были открыты электроны протоны нейтроны и какова их масса и заряд
Электрон был открыт английским физиком Дж. Томсоном в 1897 г.
Условное обозначение электрона:

— отрицательно заряженная элементарная частица
— обладает наименьшим в природе зарядом = 1э.э.з. = 1,6 х 10-19 Кл
— масса электрона по сравнению с протоном ничтожнао мала и составляет 9,1 х 10-28 г
— электрон стабилен
— не имеется никаких данных о внутренней структуре электрона/
Есть элементарные частицы «кварки», обладающие дробным зарядом ( 1э.э.з/3 и 2э.э.з./3 ) Однако, в свободном состоянии эти частицы не существуют.
В 1913 г. Э. Резерфорд выдвинул гипотезу, что одной из частиц , входящих в ядро атома любого химического элемента должно быть ядро атома водорода, т.к. было известно, что массы атомов химических элементов превышают массу атома водорода в целое число раз.
Резерфорд поставил опыт по исследованию взаимодействия альфа-частиц с ядрами атома азота. В результате взаимодействия из ядра атома азота вылетала частица, которую Резерфорд назвал протоном и предположил, что это ядро атома водорода.
Позднее с помощью камеры Вильсона было доказано, что эта частица действительно является ядром атома водорода.
Условное обозначение протона:

— масса протона равна 1а.е.м. и в 1836 раз больше массы электрона
— заряд протона является положительным и равен 1э.э.з. , т.е. равен по модулю заряду электрона
— протон стабилен
— физическое представление: напоминает облако с размытой границей, состоящее из рождающихся и аннигилирующих частиц
В 1920 г. Резерфорд высказал предположение, что должна существовать частица массой, равной массе протона, но не имеющая электрического заряда. Однако, обнаружить такую частицу Резерфорду не удалось.
Английский ученый Дж. Чедвик выдвинул гипотезу о существовании нейтральных частиц, близких по размерам и массе к протонам. Эти частицы он назвал нейтронами.
При прохождении через вещество нейтроны не теряют энергию на ионизацию атомов вещества, поэтому имеют огромную проникающую способность. Масса нейтрона чуть больше массы протона (примерно на 2,5 массы электрона).
Условное обозначение нейтрона:

В среднем за 15 минут свободный нейтрон распадается на протон, электрон и электронное антинейтрино — частицу, не имеющую ни заряда, ни массы.
Нейтроны могут быть использованы как «снаряды» в реакциях превращения одних ядер в другие.
Следующая страница «Строение ядра атома»
Назад в раздел «Атомная физика 10-11 класс»
Вспомни тему «Атомная физика» за 9 класс:
Строение атома
Атом — это электронейтральная частица, состоящая из положительно заряженного ядра и электронной оболочки.
В состав ядра входят нуклоны, или ядерные частицы. Это протоны и нейтроны. Электронная оболочка образована электронами. Протоны, нейтроны и электроны называют элементарными частицами атома.
Нуклоны в ядре удерживаются ядерным взаимодействием, энергия которого намного больше энергии химической связи. Поэтому в химических реакциях ядра не разрушаются.
Протон ((p)) — это частица с относительным зарядом (+1) и относительной массой (1).
Нейтрон ((n)) не имеет заряда, а его относительная масса тоже равна (1).
Электрон ( e − ) имеет заряд (-1), а его масса в (1837) раз меньше массы протона и нейтрона.
Строение атома можно охарактеризовать по положению химического элемента в периодической системе.
Порядковый номер элемента равен заряду ядра, числу протонов в ядре и числу электронов в его электронной оболочке.
Учитывая, что масса атома в основном сосредоточена в ядре и масса каждого нуклона равна (1), можно определить число нейтронов. Для этого от массового числа нужно отнять число протонов (порядковый номер).
порядковый номер радия Ra (88), относительная атомная масса равна (226). Значит, в атоме содержится (88) протонов и (88) электронов, а число нейтронов равно (226 — 88 = 138).
Число нейтронов в атомах одного элемента непостоянно. Поэтому атомы одного химического элемента могут различаться своими массами и существуют в виде разных нуклидов (изотопов).
Изотопы (нуклиды) — разновидности атомов с одинаковым зарядом ядра, но разными массами.
Изотопы с одинаковым зарядом ядра составляют химический элемент. Их обозначают, указывая справа вверху от символа элемента массовое число. Справа внизу часто записывают также протонное число (порядковый номер): O 8 16 , O 8 17 .
Большинство химических элементов в природе представлено несколькими разновидностями атомов. Всего их известно более (2500).
водород в природе представлен тремя изотопами. Ядро самого лёгкого изотопа (протия) состоит только из одного протона. В ядре дейтерия один протон и один нейтрон, а в ядре трития один протон и два нейтрона.
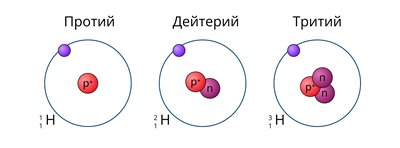
Рис. (1). Изотопы водорода
Указанная в периодической системе относительная атомная масса — это средняя масса всех существующих в природе изотопов данного элемента. Когда мы её округляем до целых, то получаем массу самого распространённого изотопа.
Кем и когда были открыты электроны протоны нейтроны и какова их масса и заряд
К 20-м годам XX века физики уже не сомневались в том, что атомные ядра, открытые Э. Резерфордом в 1911 г., также как и сами атомы, имеют сложную структуру. В этом их убеждали многочисленные экспериментальные факты, накопленные к этому времени: открытие радиоактивности, экспериментальное доказательство ядерной модели атома, измерение отношения для электрона, -частицы и для так называемой H-частицы – ядра атома водорода, открытие искусственной радиоактивности и ядерных реакций, измерение зарядов атомных ядер и т. д.
В настоящее время твердо установлено, что атомные ядра различных элементов состоят из частиц двух видов – протонов и нейтронов .
Первая из этих частиц представляет собой атом водорода, из которого удален единственный электрон. Эта частица наблюдалась уже в 1907 г. в опытах Дж. Томсона, которому удалось измерить у нее отношение . В 1919 году Э. Резерфорд обнаружил ядра атома водорода в продуктах расщепления ядер атомов многих элементов. Резерфорд назвал эту частицу протоном. Он высказал предположение, что протоны входят в состав всех атомных ядер. Схема опытов Резерфорда представлена на рис. 6.5.1.
Схема опытов Резерфорда по обнаружению протонов в продуктах расщепления ядер. К – свинцовый контейнер с радиоактивным источником -частиц, Ф – металлическая фольга, Э – экран, покрытый сульфидом цинка, М – микроскоп
Прибор Резерфорда состоял из вакуумированной камеры, в которой был расположен контейнер К с источником -частиц. Окно камеры было закрыто металлической фольгой Ф, толщина которой была подобрана так, чтобы -частицы не могли через нее проникнуть. За окном располагался экран Э, покрытый сернистым цинком. С помощью микроскопа М можно было наблюдать сцинтилляции (т. е. световые вспышки) в точках попадания на экран тяжелых заряженных частиц. При заполнении камеры азотом низкого давления на экране возникали световые вспышки, указывающие на появление потока каких-то частиц, способных проникать через фольгу Ф, практически полностью задерживающую поток -частиц. Отодвигая экран Э от окна камеры, Резерфорд измерил среднюю длину свободного пробега наблюдаемых частиц в воздухе. Она оказалась приблизительно равной , что совпадало с оценкой длины пробега H-частиц, наблюдавшихся ранее Дж. Томсоном. Исследования действия на частицы, выбиваемые из ядер азота, электрических и магнитных полей показали, что эти частицы обладают положительным элементарным зарядом и их масса равна массе ядра атома водорода. Впоследствии опыт был выполнен с целым рядом других газообразных веществ. Во всех случаях было обнаружено, что из ядер этих веществ -частицы выбивают H-частицы или протоны.
По современным измерениям, положительный заряд протона в точности равен элементарному заряду , то есть равен по модулю отрицательному заряду электрона. В настоящее время равенство зарядов протона и электрона проверено с точностью 10 –22 . Такое совпадение зарядов двух непохожих друг на друга частиц вызывает удивление и остается одной из фундаментальных загадок современной физики.
Масса протона , по современным измерениям, равна p = 1,67262∙10 –27 кг. В ядерной физике массу частицы часто выражают в атомных единицах массы (а. е. м.), равной массы атома углерода с массовым числом 12:
Следовательно, Во многих случаях массу частицы удобно выражать в эквивалентных значениях энергии в соответствии с формулой . Так как , в энергетических единицах масса протона равна .
Таким образом, в опыте Резерфорда было открыто явление расщепления ядер азота и других элементов при ударах быстрых -частиц и показано, что протоны входят в состав ядер атомов .
После открытия протона было высказано предположение, что ядра атомов состоят из одних протонов. Однако это предположение оказалось несостоятельным, так как отношение заряда ядра к его массе не остается постоянным для разных ядер, как это было бы, если бы в состав ядер входили одни протоны. Для более тяжелых ядер это отношение оказывается меньше, чем для легких, т. е. при переходе к более тяжелым ядрам масса ядра растет быстрее, чем заряд.
В 1920 г. Резерфорд высказал гипотезу о существовании в составе ядер жестко связанной компактной протон-электронной пары, представляющей собой электрически нейтральное образование – частицу с массой, приблизительно равной массе протона. Он даже придумал название этой гипотетической частице – нейтрон . Это была очень красивая, но, как выяснилось впоследствии, ошибочная идея. Электрон не может входить в состав ядра. Квантово-механический расчет на основании соотношения неопределенностей показывает, что электрон, локализованный в ядре, т. е. области размером , должен обладать колоссальной кинетической энергией, на много порядков превосходящей энергию связи ядер в расчете на одну частицу. Однако идея о существовании тяжелой нейтральной частицы казалась Резерфорду настолько привлекательной, что он незамедлительно предложил группе своих учеников во главе с Дж. Чедвиком заняться ее поиском. Через 12 лет, в 1932 г. Чедвик экспериментально исследовал излучение, возникающее при облучении бериллия -частицами, и обнаружил, что это излучение представляет собой поток нейтральных частиц с массой, примерно равной массе протона. Так был открыт нейтрон. На рис. 6.5.2 приведена упрощенная схема установки для обнаружения нейтронов.
Схема установки для обнаружения нейтронов
При бомбардировке бериллия -частицами, испускаемыми радиоактивным полонием, возникает сильное проникающее излучение, способное преодолеть такую преграду, как слой свинца толщиной в 10–20 см. Это излучение почти одновременно с Чедвиком наблюдали супруги Ирен и Фредерик Жолио-Кюри (Ирен – дочь Марии и Пьера Кюри), но они предположили, что это -лучи большой энергии. Они обнаружили, что если на пути излучения бериллия поставить парафиновую пластину, то ионизирующая способность этого излучения резко возрастает. Они доказали, что излучение бериллия выбивает из парафина протоны, которые в большом количестве имеются в этом водородосодержащем веществе. По длине свободного пробега протонов в воздухе они оценили энергию -квантов, способных при столкновении сообщить протонам необходимую скорость. Она оказалась огромной – порядка .
Дж. Чедвик в 1932 г. выполнил серию экспериментов по всестороннему изучению свойств излучения, возникающего при облучении бериллия -частицами. В своих опытах Чедвик использовал различные методы исследования ионизирующих излучений. На рис. 6.5.2 изображен счетчик Гейгера , предназначенный для регистрации заряженных частиц. Он состоит из стеклянной трубки, покрытой изнутри металлическим слоем (катод), и тонкой нити, идущей вдоль оси трубки (анод). Трубка заполняется инертным газом (обычно аргоном) при низком давлении. Заряженная частица, пролетая в газе, вызывает ионизацию молекул. Появившиеся в результате ионизации свободные электроны ускоряются электрическим полем между анодом и катодом до энергий, при которых начинается ударная ионизация. Возникает лавина ионов, и через счетчик проходит короткий разрядный импульс тока. Другим важнейшим прибором для исследования частиц является так называемая камера Вильсона , в которой быстрая заряженная частица оставляет след (трек). Траекторию частицы можно наблюдать непосредственно или фотографировать. Действие камеры Вильсона, созданной в 1912 г., основано на конденсации перенасыщенного пара на ионах, образующихся в рабочем объеме камеры вдоль траектории заряженной частицы. С помощью камеры Вильсона можно наблюдать искривление траектории заряженной частицы в электрическом и магнитном полях.
Дж. Чедвик в своих опытах наблюдал в камере Вильсона треки ядер азота, испытавших столкновение с бериллиевым излучением. На основании этих опытов он сделал оценку энергии -кванта, способного сообщить ядрам азота наблюдаемую в эксперименте скорость. Она оказалась равной . Такой огромной энергией не могли обладать -кванты, испущенные бериллием. На этом основании Чедвик заключил, что из бериллия под действием -частиц вылетают не безмассовые -кванты, а достаточно тяжелые частицы. Эти частицы обладали большой проникающей способностью и непосредственно не ионизировали газ в счетчике Гейгера, следовательно, они были электронейтральны. Так было доказано существование нейтрона – частицы, предсказанной Резерфордом более чем за 10 лет до опытов Чедвика.
Нейтрон – это элементарная частица. Ее не следует представлять в виде компактной протон-электронной пары, как первоначально предполагал Резерфорд.
По современным измерениям, масса нейтрона n = 1,67493∙10 –27 кг = 1,008665 а. е. м. В энергетических единицах масса нейтрона равна . Масса нейтрона приблизительно на две электронные массы превосходит массу протона.
Сразу же после открытия нейтрона российский ученый Д. Д. Иваненко и немецкий физик В. Гейзенберг выдвинули гипотезу о протонно-нейтронном строении атомных ядер, которая полностью подтвердилась последующими исследованиями. Протоны и нейтроны принято называть нуклонами .
Для характеристики атомных ядер вводится ряд обозначений. Число протонов, входящих в состав атомного ядра, обозначают символом и называют зарядовым числом или атомным номером (это порядковый номер в периодической таблице Менделеева). Заряд ядра равен , где – элементарный заряд. Число нейтронов обозначают символом .
Общее число нуклонов (т. е. протонов и нейтронов) называют массовым числом :
Ядра химических элементов обозначают символом , где X – химический символ элемента. Например,
– водород, – гелий, – углерод, – кислород, – уран.
Ядра одного и того же химического элемента могут отличаться числом нейтронов. Такие ядра называются изотопами . У большинства химических элементов имеется несколько изотопов. Например, у водорода их три: – обычный водород, – дейтерий и – тритий. У углерода – 6 изотопов, у кислорода – 3.
Химические элементы в природных условиях обычно представляют собой смесь изотопов. Существование изотопов определяет значение атомной массы природного элемента в периодической системе Менделеева. Так, например, относительная атомная масса природного углерода равна 12,011.
Развитие представлений о строении атома. Составные части атома – ядро (протоны, нейтроны), электроны, их заряд и масса.
Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все свойства, определенные зарядом ядра и электронной оболочкой. Атомный номер Z равен числу протонов в атомном ядре. В электронной оболочке электронейтрального атома содержится Z электронов. Массовое число A равно числу протонов Z и числу нейтронов N в атомном ядре; A = Z + N.
Нейтроны и протоны – элементарные частицы, имеющие массу ок 1 аем. Протоны — положительно заряженные микрочастицы с массой. 1 а.е.м и зарядом 1,6*10 -19 Кл., условно принятым за единицу положительного заряда. Нейтроны — нейтральные частицы с массой 1 а.е.м. История:
V в до н.э. – Демокрит вводит понятие атом-неделимый.
1896-Беккеркль открывает радиоактивность.
1897- Томсон – электрон. 1903- модель атома Томсона. «однородный шар из +заряженного вещества, в кот. Находятся электроны.
1911- Модель атома Резерфорда. Идея опыта: наблюдать отклонения заряженных частиц, пролетающих мимо атома. Результат: 1.Большинство частиц не отклоняются. 2.Небольшое кол-во частиц(1 из 20000) резко откл. назад. Объяснение: 1.В атоме много пустоты. 2.+заряд сосредоточен в объеме намного меньше объема атома. Вывод: Планетарная модель. Атом состоит из ядра и эл. оболочки. В центре атома находится положительно заряженное ядро, занимающее ничтожно малый объем атома. Весь положительный и вся масса атома сосредоточены в ядре.Заряд соостветствует кол-ву протонов в ядре и соостветствует порядковому номеру в таблице Менделеева и кол-ву электронов в атоме. Вокруг ядра вращаются электроны и их число равняется «+» заряду ядра. Однако такой атом не может быть устойчивым. Электроны не должны терять энергию, излучая ее, и упасть на ядро. В действительности электронные оболочки всех атомов устойчивы.
Энтропия. 2 закон термодинамики. 3 закон термодинамики.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы W. Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль –1 ∙K –1 . Изменение энтропии в необратимых и обратимых процессах передается соотношениями ΔS > Q / T и ΔS = Q / T. Например, изменение энтропии плавления равно теплоте (энтальпии) плавления ΔSпл = ΔHпл/Tпл Для химической реакции изменение энтропии аналогично изменению энтальпии. Энтропия вещества или системы тел при определенной температуре является абсолютной величиной. Энтропия зависит от:
- Агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию (вода, лед, пар).
- Изотопного состава (H2O и D2O).
- Молекулярной массы однотипных соединений (CH4, C2H6, н-C4H10).
- Строения молекулы (н-C4H10, изо-C4H10).
- Кристаллической структуры (аллотропии) – алмаз, графит.
стремление системы к беспорядку проявляется тем больше, чем выше температура. Произведение изменения энтропии системы на температуру TΔS количественно оценивает эту тенденцию и называется энтропийным фактором. S возрастает при переходе в-ва из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при расширении газов, при хим.взаимодействиях, приводящих к увеличению числа частиц, и прежде всего частиц в газообразном состоянии. Напротив, все процессы в результате которых упорядоченность системы возрастает(конденсация, полимеризация, сжатие, уменьшения числа частиц), сопровождаются уменьшением энтропии.
В изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики).
Энтропия равна нулю только у идеального кристалла при абсолютном нуле (третий закон термодинамики).
3. Электролиз. Электролиз водных растворов и расплавов. Законы Фарадея. Практическое применение элеткролиза.
Электролиз — окислительно-восстановительный процесс протекающий на электродах при прохождении эл тока через расплав или раствор электролита.
Сущность электролиза состоит в том, что за счет эл энергии осуществляется реакция, которая не может протекать самопроизвольно.
ФАРАДЕЯ ЗАКОНЫ, основные законы электролиза, отражающие общий закон сохранения в-ва в условиях протекания злектрохим. р-ции. Установлены M. Фарадеем в 1833-34. Согласно 1-му закону, масса в-ва т, прореагировавшего в процессе электролиза, прямо пропорциональна силе тока I и времени электролиза t, т. е. кол-ву пропущенного электричества Q = It. Согласно 2-му закону, для разных электродных процессов при одинаковом кол-ве пропущенного электричества Q массы прореагировавших в-в относятся друг к другу так же, как молярные массы эквивалентов этих в-в. Оба Ф. з. объединяются одним ур-нием:
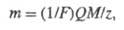
где Mz — мол. м. эквивалента в-ва, участвующего в электролизе. F — Фарадея постоянная, равная 96500 Кл/моль.
Изотопы
Работая в лаборатории Резерфорда, Фредерик Содди экспериментально установил, что встречаются атомы одного химического элемента с различной атомной массой. А поскольку к этому времени уже было известно, что количество протонов для ядра постоянно, соответственно, отличались они количеством нейтронов.
Содди предложил термин изотоп (от греческих слов изос — «равный» и топос — «место») для обозначения веществ, идентичных по химическим свойствам, но отличающихся атомной массой и определенными физическими свойствами.
При графической записи изотоп выглядит как знак химического элемента, которому он соответствует. А что бы обозначить разницу, в массовом числе используют индекс слева вверху: ( 12 C, 222 Rn)
Протий, дейтерий, и тритий — исторические собственные названия изотопов водорода.
- стабильные (устойчивые);
- нестабильные (радиоактивные).
Электронное строение атома
Исследование таинственного микромира продолжается. Изучение движения электронов и внутриатомных взаимодействий выделилось в отдельную область физики — квантовую механику. Главный постулат квантовой механики — все волны обладают свойствами частиц, а микрочастицы имеют волновую природу.
В макромире физическое тело всегда находится в какой-то конкретной точке пространства. Даже если вы сфотографируете летящую муху и на фотографии она будет в виде черной полосы, вы все равно будете уверены, что в конкретный момент времени она была в определенном месте.
В мире атома все иначе. Легкий подвижный электрон находится одновременно во всех точках околоядерного пространства. Если провести аналогию с макромиром, больше всего это напомнит неплотный клубок мягкой пушистой шерсти.
И именно эта зона пространства, где существует вероятность встретить электрон, называется электронным облаком. Плотность электронного облака неравномерна.
В электронном облаке выделяют зону, где вероятность встречи с электроном более 90% — эта область обозначена как атомная или электронная орбиталь.
Все электроны в атоме обладают определенной энергией. Чтобы описать состояние электрона, ученые используют квантовые числа. Всего их четыре. Целое число n, которое определяет энергию электронов на конкретном энергетическом уровне, называют главным квантовым числом.
На одной электронной оболочке находятся атомные орбитали с единым значением главного квантового числа n.
У невозбужденного атома электроны расположены на орбиталях 4-х видов: s, p, d и f.
Но почему нельзя было обозначить буквами по алфавиту a, b, c? Все не так просто, для обозначения атомных орбиталей ученые решили использовать начальные буквы от прилагательных, описывающих спектральные линии в атомных спектрах:
Чтобы графически представить расположение электронов на уровнях и подуровнях атомной оболочки, ученые ввели электронные формулы. Это такие численно-буквенные комбинации, где подуровень обозначен строчной латинской литерой, а цифровой индекс вверху справа обозначает количество электронов на подуровне.
Например, атом водорода имеет один электрон, который расположен на s-подуровне 1-го энергетического уровня: 1s 1 . Электроны углерода расположены на двух энергетических уровнях, на внешнем энергетическом уровне у углерода выделяют два подуровня 2s и 2p, где находятся 4 электрона. Также используется графическая схема строения атома.
Для наглядности строения атомной оболочки углерода и процессов в ней можно воспользоваться схемой , представленной на нашем ресурсе.
Несмотря на свои способности быть одновременно в любой точке пространства, электроны при заполнении орбиталей соблюдают определенный порядок:
- Принцип наименьшей энергии. Электроны занимают атомные орбитали от наименьшей энергии к наибольшей. Распределение подуровней по энергиям представлено рядом : 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, где от 1s до 7p — энергия увеличивается.
- Принцип Паули — на одной орбитали помещается два электрона. Суммарное количество электронов в одном электронном слое или на одном электронном уровне равно 2n2.
- Правило Хунда — прежде чем начать собираться в пары, электроны сначала в пределах подуровня по одному занимают вакантные орбитали.
У этого правила есть еще одно мнемоническое название — правило троллейбуса. Расположение электронов напоминает рассадку в общественном транспорте. Если есть свободные места и человек входит один, он сядет на свободное сиденье, и только если нет свободных сидений, подсядет к кому-то на свободное место.
Итак, подведем выводы, на которые ученым понадобилось более сотни лет опытов, исследований, научных дискуссий и даже трагедий.
- Форма атома — сфера.
- Ядро и электронная оболочка — составные структуры атома.
- По электронной оболочке движутся электроны с отрицательным зарядом.
- Масса ядра составляет основную часть массы атома, т.к. протон весит примерно в 2000 раз больше электрона.
- Радиус атома приблизительно в 100000 раз больше чем радиус ядра.
- Атомное ядро состоит из нуклонов: протонов (p+) и нейтронов (n0), которые состоят из кварков.
- Количество протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в периодической системе элементов, т.е. N(p+) = Z
- Количество электронов в нейтральном атоме равно количеству протонов в его ядре.
- Массовое число представляет собой сумму протонов Z и нейтронов N и обозначается литерой А.
- Если атом приобретает лишние электроны или теряет свои, то его заряд изменяется и он превращается в ион с положительным или отрицательным зарядом, что можно увидеть на иллюстрации в учебнике «Введение в естественно-научные предметы» , под редакцией А.Е. Гуревич.

Введение в естественно-научные предметы. 5 класс. Рабочая тетрадь
В тетрадь включены вопросы и расчетные задачи, экспериментальные задания и лабораторные работы. Пособие предназначено для организации самостоятельной работы учащихся при изучении нового материала, а также для закрепления и проверки полученных знаний.
Чтобы проверить насколько хорошо усвоен материал, предлагаем вашему вниманию тест на тему «Строение атома» для 8-11 классов:
- Кто придумал название атом?
- Архимед
- Менделеев
- Демокрит
- Ломоносов
- Как называются частицы, из которых состоит ядро атома?
- нуклоны
- позитроны
- феромоны
- интерфероны
- На что, согласно теории Томсона, похож атом?
- на пирожок с повидлом
- на «Киевский» торт
- на булочку с изюмом
- на горшок с медом
- Какую форму имеет атом?
- сферическую
- цилиндрическую
- кубическую
- додекаэдрическую
- Как называется составная часть нуклона?
- тверк
- кварк
- парк
- трак
- Что не является изотопом водорода?
- дейтерий
- тритий
- радий
- протий
- Как называется атом, в котором число протонов не совпадает с числом электронов?
- изотоп
- ион
- нуклон
- борион
- Сколько электронов помещается на одной орбитали?
- 3
- 10
- 2
- 15
- Какая наука изучает движение электронов?
- квантическая химия
- механическая биология
- коллоидная математика
- квантовая механика
- Основная масса атома содержится?
- в ядре
- в электронах
- в орбиталях
- в протонах