Атом – это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. Все электроны атома образуют его электронную оболочку, строение которой определяет многие химические свойства элемента.
Электрон (ē) – это отрицательно заряженная микрочастица, входящая в состав атома и несущая наименьший электрический заряд. Заряд электрона в кулонах оказался величиной чрезвычайно малой (1,610 -19 Кл), поэтому для удобства величина этого «элементарного» заряда принята за единицу qe=-1. Так как атом в целом электронейтрален, то число электронов, движущихся вокруг ядра, равно заряду ядра этого атома. Например, заряд ядра атома натрия +11. Вокруг ядра размещается 11 электронов с общим отрицательным зарядом –11. Самый простой состав имеет ядро атома водорода – один положительный заряд и массу, близкую к единице атомной массы. Ядро водорода назвали протоном. Протон (р + ) – это микрочастица, входящая в состав ядра атома, имеющая положительный заряд qр=+1 и массу, близкую к 1 а.е.м.. В любом атоме число протонов в ядре равно числу электронов. Нейтрон (n 0 ) – это электронейтральная микрочастица, входящая в состав ядра атома, его масса, как и масса протона, близка к 1 а.е.м..
Масса электронов в атоме очень мала – он почти в две тысячи раз легче протона, поэтому массой электрона в атоме пренебрегают и масса атома считается равной сумме масс протонов и нейтронов, т.е. сумме количества протонов и нейтронов в атоме.
Большинство элементов в природе встречаются в виде атомов, характеризующихся разными атомными массами. Такие атомы называются изотопы – атомы, имеющие одинаковый заряд ядра, но разные атомные массы. Это объясняется тем, что они содержат одинаковое число протонов, но разное число нейтронов. Например, изотопы водорода: протий, дейтерий и тритий. Ядро протия состоит из одного протона, дейтерия – из одного протона и одного нейтрона, трития – из одного протона и двух нейтронов.
Атомы различных изотопов одного и того же элемента наряду с разными ядерными свойствами имеют одинаковое строение электронной оболочки, поэтому химические и физические свойства изотопов почти одинаковы.
Строение электронной оболочки
Электроны характеризуются двойственной природой: они имеют свойства и частицы, и волны. Для движущегося электрона невозможно указать его точное местоположение, можно лишь определить вероятность нахождения электрона в различных частях внутриатомного пространства. Область пространства, в которой наиболее вероятно нахождение электрона, называется атомной орбиталью (АО).
Состояние электрона в атоме характеризуется четырьмя квантовыми числами.
Главное квантовое число n определяет энергию электрона в атоме и размер АО, т.е. удаленность электрона от ядра. Главное квантовое число n принимает значения целых чисел 1, 2, 3, 4… Совокупность электронов с одинаковым значением n называется энергетическим уровнем. Наименьшую энергию имеют электроны первого от ядра энергетического уровня (n=1); с увеличением n энергия электрона и его удаленность от ядра возрастают. Состояние атома, когда его электроны находятся на таких энергетических уровнях, что их суммарная энергия является минимальной, называется основным, или невозбужденным. Состояния с более высокими значениями энергии называются возбужденными. Энергетические уровни обозначают буквами:
Электрический заряд и элементарные частицы | Физика 10 класс #44 | Инфоурок
Числовое значение n 1 2 3 4 5 6 7
Буквенное обозначение K L M N O P Q.
На одном и том же энергетическом уровне могут находиться атомные орбитали различной формы, отличающиеся друг от друга по энергии. Поэтому энергетические уровни разделяются на подуровни. Энергию электрона на подуровне и форму атомной орбитали характеризует орбитальное квантовое число l. Значение l зависит от главного квантового числа: l принимает значения от 0 до (n–1), т. е. 0, 1, 2, 3… (n–1). В пределах данного энергетического уровня совокупность электронов, характеризующихся одинаковым значением l, называется энергетическим подуровнем. Подуровни обозначают буквами:
Орбитальное квантовое число l 0 1 2 3
Обозначение энергетического подуровня s p d f.
Таким образом, при l = 0, 1, 2, 3 электроны находятся соответственно на s-, p-, d-, f-подуровнях. При данном значении главного квантового числа n наименьшую энергию имеют электроны s-подуровня, затем p-, d-, f-подуровней. Электроны различных подуровней называют s-, p-, d-, f-электронами. В этом случае говорят также о состояниях s-, p-, d-, f-электронов, или s-, p-, d-, f-атомных орбиталях.
Число энергетических подуровней в уровне не должно быть больше главного квантового число n. Так, первый уровень (n=1) имеет один подуровень (s), второй уровень (n=2) – два подуровня (s и p), третий (n=3) – три (s, p, d), четвертый (n=4) – четыре (s, p, d, f). В оболочках атомов ныне известных элементов электроны застраивают на каждом уровне не более четырех подуровней. Уровни O (n=5), P (n=6), Q (n=7) содержат по четыре подуровня.
Каждый подуровень составлен из орбиталей, количество которых определяется магнитными квантовым числом ml. Магнитное квантовое число ml определяет возможные ориентации орбитали в пространстве, связано с орбитальным квантовым числом и может принимать целочисленные значения от –l до +l, включая ноль. Определенному значению l соответствует (2l+1) возможных значений магнитного квантового числа. Число значений ml указывает на число атомных орбиталей в подуровне и число возможных направлений, по которым они могут ориентироваться в пространстве.
Для s-подуровня l=0 и потому ml имеет единственное значение: ml =0. Таким образом, на s-подуровне имеется единственная s-орбиталь, которая расположена симметрично ядру атома. Для p-подуровня l=1 и ml приобретает три значения: –1, 0, 1, т. е. р-подуровень имеет три р-орбитали и они ориентированы по трем осям координат; d-подуровень (l=2) имеет пять значений ml: –2, –1, 0, 1, 2 и, следовательно, пять d-орбиталей, которые ориентированы по пяти разным направлениям; f-подуровень (l=3) имеет семь значений ml: –3, –2, –1, 0, 1, 2, 3, т. е. семь f-орбиталей. Число ориентаций f-орбиталей равно семи.
У

 словно атомные орбитали АО обозначают в виде квадрата (квантовой ячейки) Error: Reference source not found. Соответственно для s-подуровня имеется одна АО Error: Reference source not found, для p‑подуровня – три АО , для d-подуровня – пять АО Error: Reference source not found, для f‑подуровня – семь АО .Error: Reference source not found
словно атомные орбитали АО обозначают в виде квадрата (квантовой ячейки) Error: Reference source not found. Соответственно для s-подуровня имеется одна АО Error: Reference source not found, для p‑подуровня – три АО , для d-подуровня – пять АО Error: Reference source not found, для f‑подуровня – семь АО .Error: Reference source not found
Таким образом, электроны в атоме располагаются по энергетическим уровням, удаленность которых от ядра характеризуется значением главного квантового числа n; уровни состоят из подуровней, число которых для каждого уровня не превышает значение n; в свою очередь, подуровень состоит из орбиталей, форма которых определяется значением орбитального квантового числа l, а количество задается числом значений магнитного квантового числа ml. Квантовые числа n, l, ml характеризуют орбиталь.
Кроме движения вокруг ядра, электрон вращается вокруг собственной оси. Это движение получило название «спин». Спиновое квантовое число ms характеризует два возможных направления вращения электрона вокруг собственной оси (по часовой стрелке или против). Спиновое квантовое число ms принимает два значения: + 1 /2 и – 1 /2. Электроны с разными спинами обычно обозначаются противоположно направленными стрелками ↓↑.
Четыре квантовых числа n, l, ml, ms полностью характеризуют состояние электрона в атоме.
Состав атомного ядра. Число протонов
Предложенная Э. Резерфордом в (1911) году ядерная (планетарная) модель строения атома сводится к следующим положениям:
- атом состоит из положительно заряженного ядра и движущихся вокруг него электронов;
- более (99,96) % массы атома сосредоточено в его ядре;
- диаметр ядра примерно в сто тысяч раз меньше диаметра самого атома.
Согласно этой модели можно дать следующее определение атома:
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Ядро атома состоит из элементарных частиц: протонов и нейтронов . Протоны и нейтроны имеют общее название нуклоны (ядерные частицы).
Протон ((p)) — частица, имеющая заряд (+1) и относительную массу, равную (1).
Нейтрон ((n)) — частица без заряда с относительной массой (1).
К элементарным частицам относятся также электроны ( е _ ), которые образуют электронную оболочку атома.
Рис. (1). Строение атома
Протоны и нейтроны имеют одинаковую массу. Масса электрона составляет 1 1840 массы протона и нейтрона. Поэтому основная масса атома сосредоточена в его ядре.
Протон имеет положительный заряд (+1). Заряд электрона — отрицательный и по величине равен заряду протона: (–)(1).
Физика 8 класс. Урок№33. Строение атомов.
На прошлых уроках мы с вами говорили о том, что в природе существует два вида электрических зарядов — положительный и отрицательный, что связано с их компенсирующим взаимным действием.
Так же мы выяснили, что электрический заряд любого заряженного тела дискретен, то есть кратен наименьшему элементарному заряду — заряду электрону.
Давайте вспомним, что электрон — это очень маленькая частица, гораздо меньше атома или молекулы. Также была найдена и частица, обладающая элементарным положительным зарядом. Это протон.
Таким образом в начале XX в. было достоверно известно, что в состав атома входят отрицательно заряженные частицы — электроны, и частицы с положительным зарядом, т. е. протоны. Однако их взаимное расположение в атоме было вовсе не очевидным.
Первая модель атома была предложена английским учёным Дж. Томсоном в тысяча девятьсот четвёртом году. Согласно его модели, атом представляет собой однородный шар из положительно заряженного вещества, внутри которого находятся электроны. Причём число электронов полностью компенсирует суммарный положительный заряд атома.

Эта модель чем-то напоминала булочку с изюмом. Отсюда и произошёл термин «пудинговая модель атома».
Но предложенная Томсоном модель оказалась в полном противоречии с опытами по исследованию распределения положительного заряда в атоме, которые были проведены в тысяча девятьсот одиннадцатом году английским физиком Э. Резерфордом.
Суть его опыта можно понять из такого сравнения. Пусть нужно проверить, однородно ли какое-либо тело. Например, не спрятана ли гиря в стоге сена, не дотрагиваясь до стога. Для этого будем использовать мелкокалиберную винтовку и большой фанерный щит. Начнём стрелять в стог по различным направлениям и внимательно следить по пробоинам в щите за траекториями всех пуль. Если в стогу гиря не спрятана, то есть стог сена является однородным, то не будет ни одного рикошета.

Они появятся только при наличии в стоге предмета, причём число рикошетов будет зависеть от размеров этого предмета (например, эта торговая килограммовая гиря, или же гимнастическая двухпудовая).

В опытах Резерфорда тончайшая плёнка из золота обстреливалась положительно заряженными частицами и оценивались траектории их движения после прохождения плёнки. Опыты Резерфорда (более подробно о них пойдёт речь в старших классах) убедительно показали, что атом очень неоднороден.
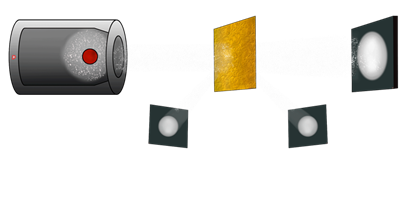
Иначе, как объяснить, что некоторые положительно заряженные частицы изменяли направление движения, хотя их число было чрезвычайно малым.
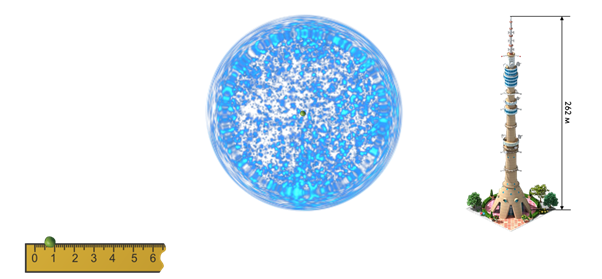
Опыт позволил утверждать, что более 99,9% десятых процента его массы и весь положительный заряд сосредоточены в чрезвычайно малой области в центре атома, которую назвали ядром атома. Резерфорд оценил размер этого ядра — его поперечник примерно в 100 000 раз меньше поперечника самого атома. Чтобы представить себе, что это означает, рассмотрим такую наглядную модель. Представьте себе, что атомное ядро увеличено до размеров горошины. Тогда диаметр атома был бы равен высоте Останкинской телебашни.
В 1919 г. Резерфордом были экспериментально обнаружены носители положительного заряда ядра — протоны. Название частиц происходит от греческого слова первичный, основной, что подчёркивает то, что протоны являются основой, базой ядер всех без исключения атомов.
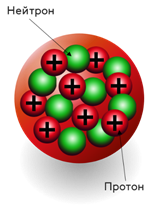
Кроме протонов, в ядре также находятся электронейтральные частицы — нейтроны, которые были открыты английским учёным Дж. Чедвиком.
Таким образом, было установлено, что вокруг ядра, состоящим из протонов и нейтронов, удерживаемые взаимодействием с ним, на очень большом расстоянии непрерывно движутся отрицательно заряженные электроны.
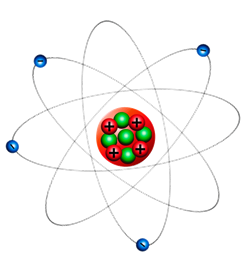
Возникает закономерный вопрос: Почему же отрицательные, обладающие малой массой электроны атома не устремятся к ядру и не соединятся с массивным положительно заряженным ядром? Оказывается, по той же причине, по которой наша Земля не падает на притягивающее её с гигантской силой Солнце. Электроны, подобно планетам Солнечной системы, вращаются вокруг ядра, но только вращение это гораздо более быстрое.
Так, в атоме водорода его единственный электрон за одну секунду делает вокруг ядра около семи квадриллионов оборотов! Попытайтесь представить время его пребывания на небольшом участке траектории!
Из-за того, что поведение электронов подобно поведению планет в нашей Солнечной системе, модель строения атома, вытекающую из опыта Резерфорда, называют планетарной моделью.
Выдающийся русский учёный Дм. И. Менделеев заметил периодическую повторяемость свойств элементов по мере роста атомной массы, с чем вы познакомитесь в курсе химии. Мы же с вами обратим внимание на другое обстоятельство: так как всякий атом нейтрален, то число электронов на орбитах обязательно равно числу протонов в ядре.
Например, самый простой из встречающихся в природе атомов — атом водорода — состоит из одного протона и вращающегося вокруг него одного электрон.

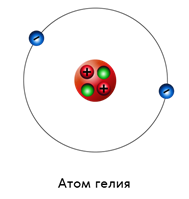
Второй по сложности — это атом гелия. В его ядре два протона и два нейтрона, а вокруг вращаются два электрона.
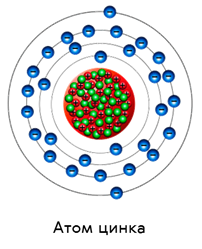
Из такого сравнения не трудно заметить, что в нейтральном атоме число электронов равно числу протонов. А вот число нейтронов может быть разным. Так, например, у атома цинка тридцать протонов и электронов, а вот нейтронов — тридцать пять.
Сравнивая строение атома со строением нашей Солнечной системы, не будем забывать о том, что наша планетная система практически лишена возможности столкновения с себе подобной, в то время как столкновения атомов друг с другом следуют неизбежно и непрерывно. Так, даже в обычном воздухе, где молекулы расположены в среднем на значительных расстояниях, каждая из них испытывает за одну секунду около миллиарда столкновений! При таких столкновениях чрезвычайно часто, особенно при повышении температуры, может происходить потеря атомом одного и даже более электронов, что приводит к нарушению электрической нейтральности.
Частица, потерявшая электрон, обладает нескомпенсированным положительным зарядом. Такую частицу называют положительным ионом, а произошедший процесс, который привёл к появлению вместо нейтральной частицы (атома) двух разноименно заряженных частиц (электрона и иона) — ионизацией.
Говоря об ионизации, нужно отметить, что этим термином в физике описывают не только процесс образования электрона и положительного иона, но и появление отрицательных ионов. Все дело в том, что электрон не только может быть потерян нейтральным атомом, но и приобретен им от другого атома. Например, в обычной поваренной соли (соединение атома натрия и хлора) атом натрия легко теряет электрон, который переходит к атому хлора, что приводит к появлению пары разноимённых ионов.
Само слово «ион» (от греческого идущий) говорит о способности этих частиц передвигаться при взаимодействии с другими заряженными частицами. Именно благодаря движениям ионов обоих знаков осуществляется проводимость в жидкостях.
Заметим в заключение, что физические свойства тел зависят не только от строения их атомов, но и от расположения и взаимодействия этих атомов друг с другом. Например, довольно мягкий и являющийся хорошим проводником графит очень мало похож на самое твердое природное вещество, обладающее великолепными изолирующими свойствами, — алмаз, хотя атомы, образующие их, одинаковы — это атомы углерода, имеющие в этих веществах различное взаимное расположение.

Домашнее задание
Стр. 85 — 86 читать. Упр. 20

Всё о Тур ции
Здесь вы найдете информацию о культуре, истории, традициях и обычаях этой прекрасной страны.
Атомы
Атом — это мельчайшая химически неделимая частица вещества, а также наименьшая часть химического элемента, являющаяся носителем его свойств. Химически неделимая означает, что атом в ходе химических реакций не делится на более мелкие части.
Атомы очень маленькие частицы, их размер находится в диапазоне от одного до пяти ангстрем (обозначается — Å.). Один ангстрем — это 10 –10 метра.
Состав и строение атомов
Атомы состоят из ещё более мелких частиц.
В центре любого атома находится положительно заряженное ядро. В пространстве вокруг ядра находятся отрицательно заряженные частицы — электроны, которые образуют так называемое электронное облако . Таким образом, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Пример. Атом гелия состоит из ядра, в котором находятся два протона и два нейтрона, и двух электронов:

Ядро атома — это центральная часть атома, в которой сосредоточена основная его масса и весь положительный электрический заряд. Ядро атома состоит из протонов и нейтронов.
Протон — это частица, которая имеет положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона — p + .
Нейтрон — это частица, не имеющая электрического заряда. Заряд нейтрона равен 0. Символ нейтрона — n 0 .
Протоны и нейтроны имеют общее название — нуклоны.
Ядра атомов имеют положительный заряд, так как состоят из протонов с положительным зарядом и нейтронов. По величине заряд равен количеству протонов в ядре и совпадает с порядковым номером элемента в периодической системе.
Электрон — это частица, которая имеет отрицательный электрический заряд. Заряд электрона в условных единицах равен -1. Символ электрона — e .
Протоны, нейтроны и электроны имеют общее название — элементарные частицы или субатомные частицы.
| Протон | p + | +1 |
| Нейтрон | n 0 | 0 |
| Электрон | e | -1 |
Заряд протона и электрона одинаковы по величине, но противоположны по знаку. Любой атом содержит равное число протонов и электронов, значит заряд ядра и суммарный заряд всех электронов атома одинаковы по величине, но противоположны по знаку. Следовательно, атомы являются электронейтральными частицами.
Определение 2
ЭЛЕКТРО́Н, -а, мужской род, устарелое Сплав алюминия с магнием, литием и цинком, обладающий большой легкостью, прочностью и пластичностью.
[От греч. ’ήλεκτρον — сплав золота с серебром]
Электро́н (от древне-греческого ἤλεκτρον «янтарь») — субатомная частица (обозначается символом e −
или β −
), чей электрический заряд отрицателен и равен по модулю одному элементарному электрическому заряду. Электроны принадлежат к первому поколению лептонных частиц и обычно считаются фундаментальными частицами, поскольку у них нет известных компонентов или субструктур. Электрон имеет массу, которая составляет приблизительно 1/1836 массы протона. Квантово-механические свойства электрона включают собственный угловой момент (спин) полуцелого значения, выраженного в единицах приведённой постоянной Планка, ħ, что делает их фермионами. В связи с этим никакие два электрона не могут занимать одно и то же квантовое состояние в соответствии с принципом запрета Паули. Как и все элементарные частицы, электроны обладают свойствами как частиц, так и волн: они могут сталкиваться с другими частицами и могут дифрагировать как свет. Волновые свойства электронов легче наблюдать экспериментально, чем свойства других частиц, таких как нейтроны и протоны, потому что электроны имеют меньшую массу и, следовательно, большую длину волны де Бройля для равных энергий.
Электроны играют существенную роль во многих физических явлениях, таких как электричество, магнетизм, химия и теплопроводность, а также участвуют в гравитационных, электромагнитных и слабых взаимодействиях. Поскольку электрон имеет заряд, его окружает электрическое поле, и если этот электрон движется относительно наблюдателя, то наблюдатель увидит также магнитное поле. Электромагнитные поля, создаваемые другими источниками, будут влиять на движение электрона в соответствии с законом Лоренца. Электроны излучают или поглощают энергию в виде фотонов при ускоренном движении. Лабораторные приборы способны улавливать отдельные электроны, а также электронную плазму с помощью электромагнитных полей. Специальные телескопы наблюдают электронную плазму в космическом пространстве. Электроны используются во многих приложениях, таких как трибология, электролиз, электрохимия, аккумуляторные технологии, электроника, сварка, электронно-лучевые трубки, фотоэлектричество, солнечные панели, электронные микроскопы, лучевая терапия, лазеры, детекторы на основе ионизации газов и ускорители частиц.
Взаимодействия электронов с другими субатомными частицами представляют интерес в химии и ядерной физике. Кулоновское взаимодействие между положительно заряженными протонами внутри атомных ядер и отрицательно заряженными электронами позволяет образовать из них атомы. Ионизация или различия в пропорциях отрицательного заряда электронов по сравнению с положительными зарядами ядер изменяют энергию связи атомной системы. Обмен или совместное использование электронов между двумя или более атомами является основной причиной химической связи. В 1838 году британский естествоиспытатель Ричард Лэминг впервые выдвинул гипотезу о неделимом количестве электрического заряда для объяснения химических свойств атомов. Ирландский физик Джордж Джонстон Стони назвал этот заряд «электроном» в 1891 году, а Дж. Дж. Томсон и его команда британских физиков идентифицировали его как частицу в 1897 году во время эксперимента с электронно-лучевой трубкой. Электроны также могут участвовать в ядерных реакциях при нуклеосинтезе в звёздах, где они известны как бета-частицы. Электроны могут образовываться в результате бета-распада радиоактивных изотопов и при высокоэнергетических столкновениях, например, когда космические лучи попадают в атмосферу. Античастица электрона называется позитроном; он идентичен электрону, за исключением того, что несёт положительный электрический заряд. Когда электрон сталкивается с позитроном , обе частицы могут аннигилировать, создавая фотоны гамма-излучения.
Какая элементарная частица входит в состав атома и обладает отрицательным зарядом
8(800) 333 58 91
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/2/ava/thumbnails/qYIsb3Bdhb458iZ.jpg)
Меня зовут Кузьмин Владимир Александрович.
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Укажите реальные данные, иначе мы не сможем с вами связаться! Отправляя форму, Вы принимаете Условия использования и даёте Согласие на обработку персональных данных
Отправить заявку
Основы химии

Данный курс предназначен для тех, кто желает более подробно познакомиться с такой замечательной наукой, как химия и углубить свои знания.
Мы рекомендуем его учителям химии средней школы, репетиторам химии и ученикам профильных классов.
Курс состоит из разделов, каждый из которых посвящён определённой теме. Разделы рекомендуется изучать по порядку. Пока не все темы Вы сможете найти здесь, так как курс только начал пополняться материалами. В разделах особое внимание уделяется спорным теоретическим и методологическим моментам, а также распространённым заблуждениям некоторых авторов.
С уважением, Кузьмин Владимир Александрович.