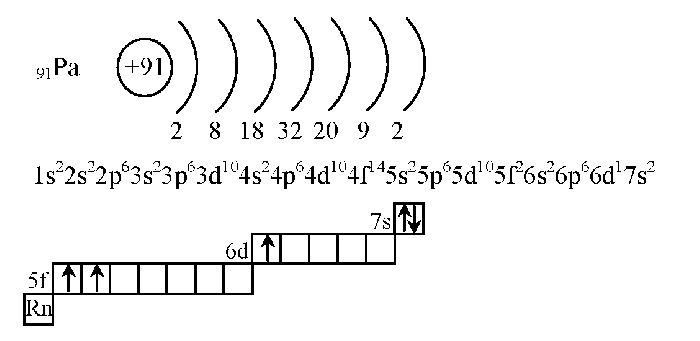
Первые упоминая об атоме появились еще в Древней Греции, в писаниях философа Демокрита. он говорит о нем как о неделимой частице. Дальнейшее учение продолжилось в 18 веке российским ученым М.В. Ломоносовым, а после английским Дж. Дальтоном.
Более точное строение описал английский ученый в 1911 году Э. Резерфорд, проводя опыты он выяснил, что атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов, данная модель получила название «Планетарная модель атома».
В ходе ряда опытов, было выяснено, что число протонов (p) равно порядковому номеру, а так как атом в целом нейтральная частица, то число отрицательных частиц равно числу положительных, т.е. число электронов (ē) равно числу протонов, а также заряду атома (Z).
Вся масса (Ar) сосредоточена в ядре, ядро состоит из протонов и нейтронов (n), массу можно посмотреть в периодической системе, следовательно, можно найти число нейтронов:
p = ē = Z = порядковому номеру
Теперь разберем более подробное строение электронной оболочки. Вокруг ядра есть энергетические уровни (электронный слой), их количество равно номеру периода, на каждом электронном слое может находиться определенное число электронов, максимальное число электронов на уровне можно найти по формуле:
N = 2n 2 , где n – это номер энергетического уровня
n = 1, N=2*1 2 = 1
n = 2, N = 2*2 2 = 8 и так далее
Последний (внешний) уровень у элемента в большинстве случаев не заполнен полностью, число электронов на внешнем уровне для главных подгрупп равно номеру группы, например, барий элемент IIA группы, значит на внешнем уровне будет 2 электрона, а у фосфора будет 5, т.к. он элемент VA группы.
Заполнение электронных слоёв атомов элементов малых периодов
Общее число электронов в атоме равно порядковому номеру химического элемента в Периодической таблице.
Каждый электрон находится на своей орбитали. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Электроны с близкими значениями энергии образуют энергетический уровень ( электронный слой ).
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии.
Энергетические уровни нумеруют, начиная с самого близкого к ядру.
Установлено, что максимальное число электронов на энергетическом уровне равно (2n²), где (n )— его номер. Значит, на первом уровне может находиться не более (2) электронов, на втором — не более (8), на третьем — не более (18) и т. д.
В атоме водорода — один электрон, и он располагается на первом энергетическом уровне:
В атоме гелия — два электрона. Первый энергетический уровень у гелия завершён, так как он не может содержать более двух электронов:
В атоме лития — три электрона. Два из них находятся на первом уровне. Третий электрон имеет большую энергию и движется дальше от ядра. В атоме лития появляется второй энергетический уровень:
БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атома
Li 3 ) 2 ) 1 .
У следующих элементов второго периода электроны добавляются на второй уровень:
Be 4 ) 2 ) 2 ; B 5 ) 2 ) 3 ; C 6 ) 2 ) 4 ; N 7 ) 2 ) 5 ; O 8 ) 2 ) 6 ; F 9 ) 2 ) 7 ; Ne 10 ) 2 ) 8 .
У неона второй электронный слой завершён, так как содержит (8) электронов — максимально возможное число.
Заполнение третьего энергетического уровня начинается у атома натрия и завершается у атома аргона:
Na 11 ) 2 ) 8 ) 1 ; Mg 12 ) 2 ) 8 ) 2 ; Al 13 ) 2 ) 8 ) 3 ; Si 14 ) 2 ) 8 ) 4 ; P 15 ) 2 ) 8 ) 5 ; S 16 ) 2 ) 8 ) 6 ; Cl 17 ) 2 ) 8 ) 7 ; Ar 18 ) 2 ) 8 ) 8 .
Максимальное количество электронов на третьем слое равно (18), но у элементов третьего периода его заполнение не происходит, потому что внешний электронный слой не может содержать более (8) электронов.
Формула для подсчета максимального числа электронов на уровне
Для определения максимально возможного числа электронов на энергетическом уровне используется формула:
где N — число электронов, n — номер уровня.
Например, для первого уровня n=1 и максимальное число электронов равно:
Для второго уровня (n=2):
Для третьего уровня (n=3):
И так далее. Эта формула позволяет легко рассчитать максимальную вместимость любого энергетического уровня в атоме.
Правила заполнения электронных оболочек
Хотя каждый уровень имеет определенную максимальную емкость, реальное число электронов на нем может быть меньше. Электроны заполняют уровни в порядке возрастания энергии:
- 1s (2 электрона)
- 2s, 2p (8 электронов)
- 3s, 3p, 3d (18 электронов)
Внутри уровня действует правило Хунда — сначала заполняются орбитали с одинаковыми значениями орбитального квантового числа (s, p, d, f).
На последнем уровне число электронов соответствует номеру группы элемента в периодической системе. Эти электроны называют валентными и определяют химические свойства атома.
Например, для калия:
Калий расположен в 4 периоде, поэтому имеет 4 электронных уровня. На последнем уровне 1 электрон (калий относится к 1 группе).
Таким образом, зная положение элемента в таблице Менделеева, можно определить электронную структуру его атома.

Строение атома

Для удобства будем использовать планетарную модель строения атома Н. Бора, согласно которой в центре атома располагается положительно заряженное ядро, состоящее из протонов и нейтронов, а вокруг двигаются электроны по «орбитам» и образуют электронную оболочку
Вся необходимая для построения модели атома информация находится в Периодической системе химических элементов Д.И. Менделеева:
- Порядковый номер элемента равен количеству протонов (р + ) в ядре этого атома, так у лития три протона, у бериллия – четыре, а у натрия одиннадцать. Известно, что атом – нейтральная частица, количество протонов в ней всегда будет равно количеству электронов. Поэтому порядковый номер определяет не только заряд ядра, но и общее количество электронов на всех орбиталях атома этого элемента.
Строение атома
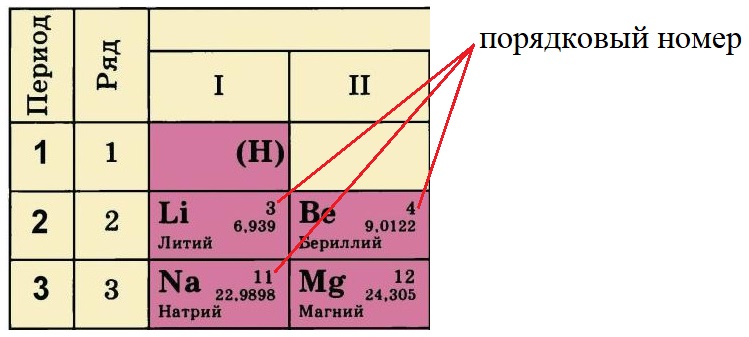
Порядковый номер в таблице Менделеева
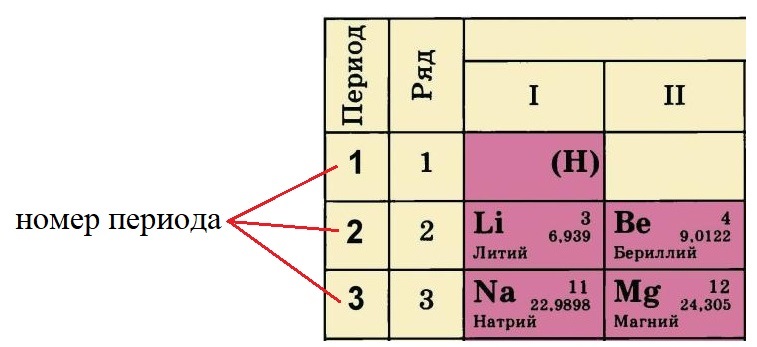
- Номер периода, в котором располагается данный элемент, показывает, на каком количестве уровней находятся электроны. Так, электроны лития и бериллия располагаются на двух уровнях, а натрия и магния – на трёх.
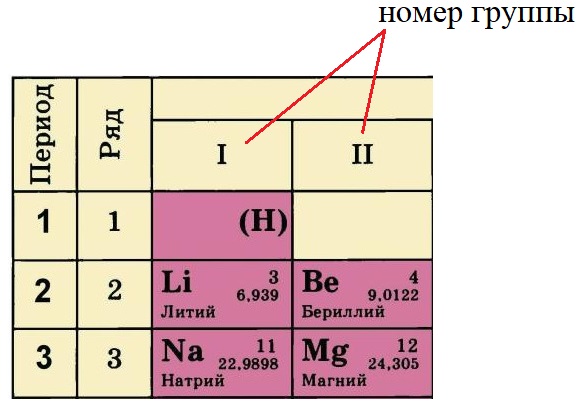
- Номер группы, в котором стоит элемент определяет количество электронов на внешнем уровне (валентные электроны). У лития и натрия по одному электрону на внешнем уровне, а у бериллия и магния – по два. Это правило действует только на элементы А-подгрупп.
А-подгруппа и Б-подгруппа.
Как определить, какой элемент относится к А-подгруппе, а какой – к B (Б)-подгруппе?
Некоторые таблицы содержат эту информацию:
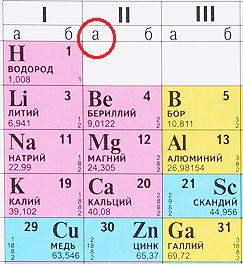
Но большинство таблиц имеет только обозначения групп. Что делать в таком случае? Всё просто: ориентируйтесь по элементам второго периода, они все являются элементами А-подгрупп (литий, бериллий, бор, углерод, азот, кислород, фтор, неон), те элементы, что располагаются прямо под ними тоже относятся к А-подуровню:
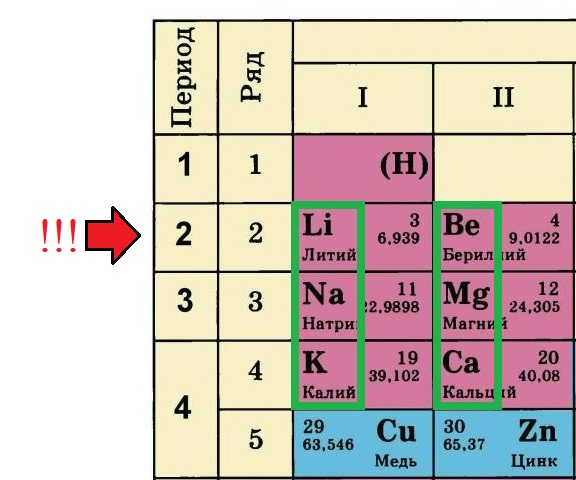
В данном примере зеленым прямоугольником выделены элементы А-подгрупп, так как с них начинается второй период ПС. А значок меди и цинка расположен с другой стороны, это элементы В-подгрупп.
Пример построения модели атома.
Теперь попробуем составить электронную конфигурацию атома бериллия. Последовательность действий отображена цифровыми обозначениями на рисунке, изображающем фрагмент ПС:
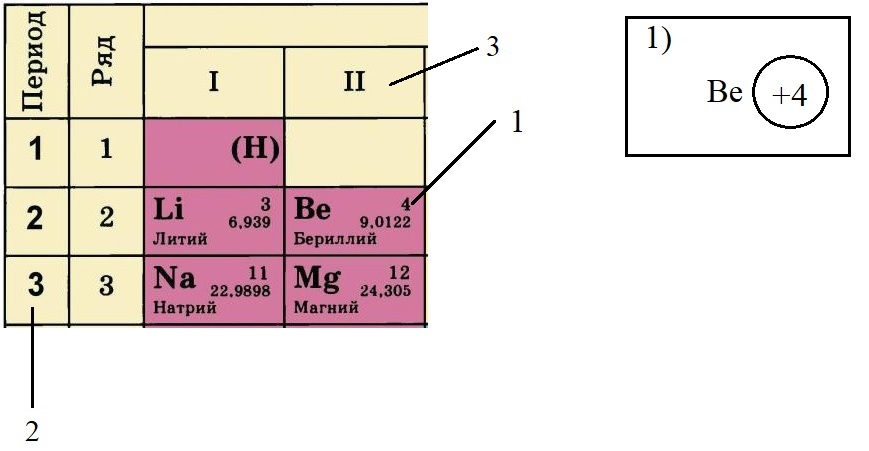
- По порядковому номеру определяем заряд ядра, записываем в круг после символа элемента. Помним, что это еще и количество электронов.
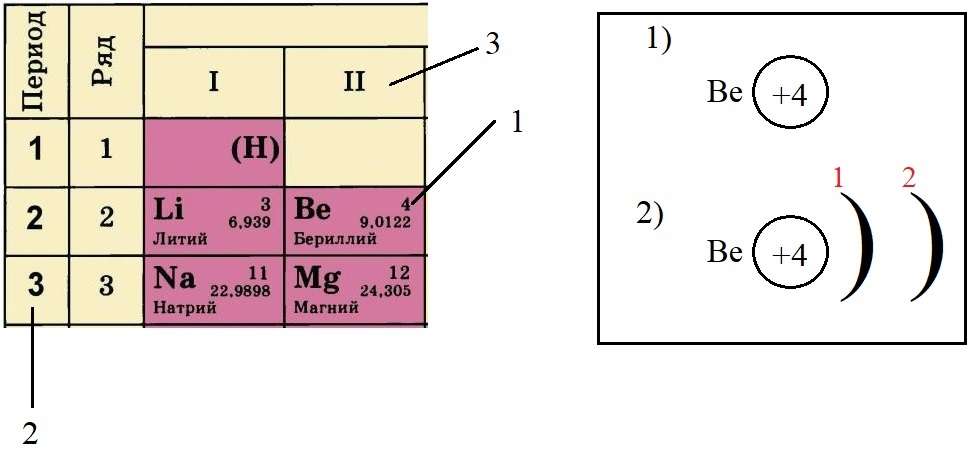
- Определяем количество энергетических уровней, оно равно номеру периода, в котором стоит элемент. Бериллий стоит во втором периоде, значит, у него два энергетических уровня:
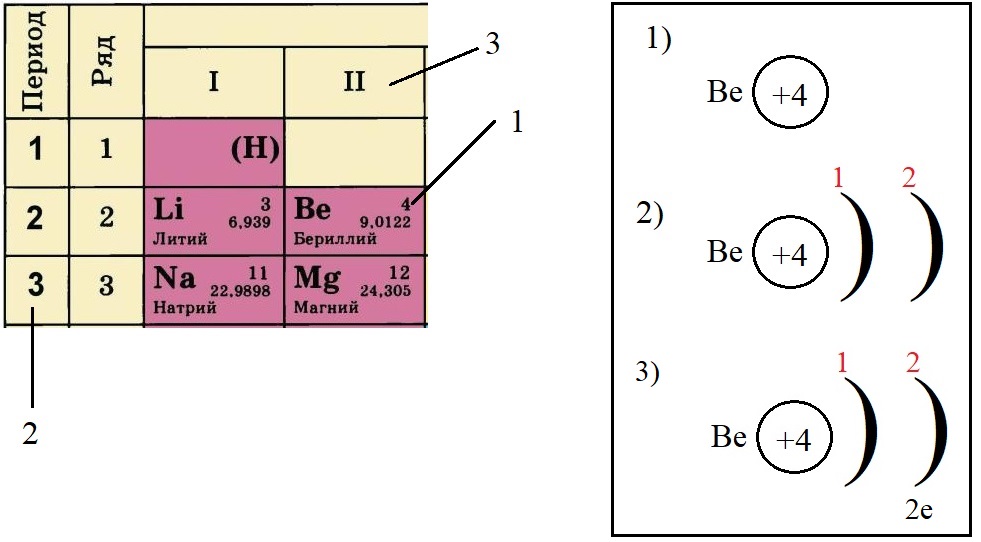
- Определяем количество электронов на внешнем уровне, оно равно номеру группы. Бериллий стоит во второй группе, у него два электрона на внешнем слое:
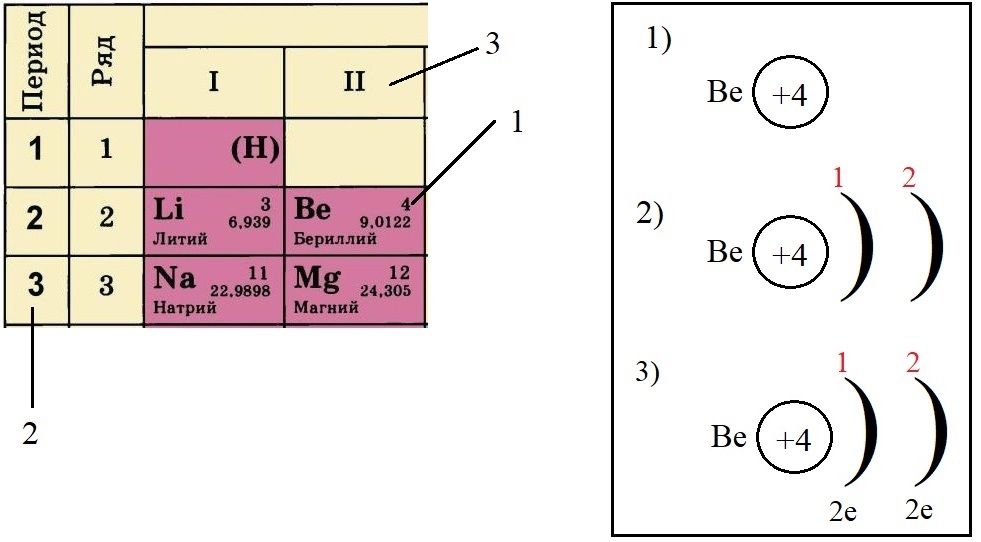
- Не трудно догадаться, что если всего у бериллия должно быть четыре электрона, два из которых находятся на внешнем слое, то оставшиеся два находятся на внутреннем слое:
Максимальное количество электронов на уровнях
Чтобы строить электронные конфигурации более крупных атомов, необходимо ввести еще несколько данных. Начнем с максимального количества электронов на определенном уровне, это количество показано на рисунке:

Стоит помнить, что это лишь максимальное количество, большинство элементов не имеют на каждом уровне такого количества электронов.
Так же следует помнить, что какой бы номер не имел бы внешний уровень, на нем максимальное количество электронов не должно превышать восьми.
Следует учитывать, что предвнешний слой следует заполнять последним, чтобы избежать ошибок.
Рассмотрим данные правила на примере построения конфигурации атома кальция.
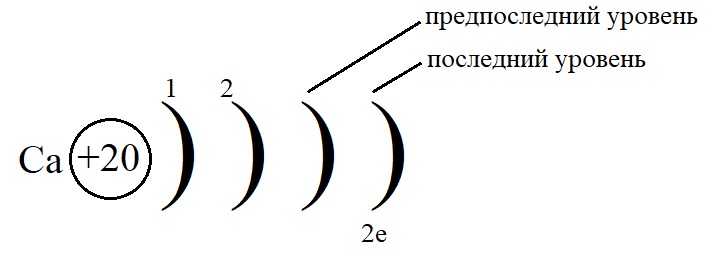
- Порядковый номер кальция – 20, у него 20 протонов в ядре и 20 электронов на орбиталях. Кальций стоит во второй группе, значит, на внешнем слое у него 2 электрона.
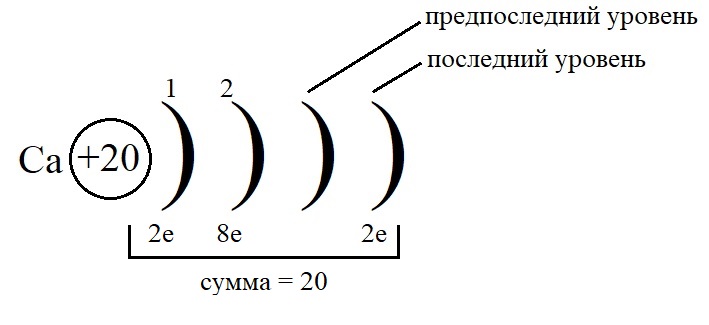
- Остальные уровни, кроме предвнешнего, заполняем по максимальному количеству на этих слоях:
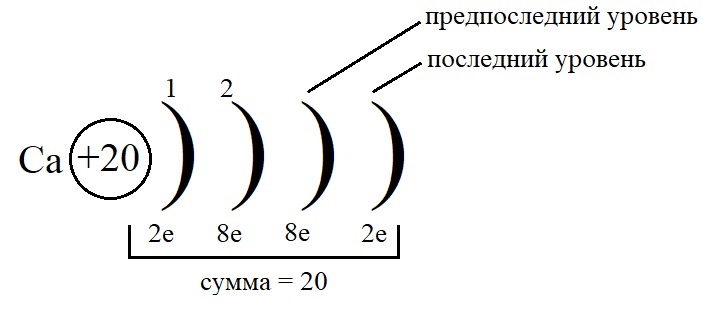
- Как показано на рисунке, общее количество электронов должно быть равным двадцати, а пока мы распределили только двенадцать, значит, на предпоследнем уровне необходимо поставить восемь электронов:
Каждый энергетический уровень можно разбить на подуровни (орбитали). Их существует 4 вида: s-, p-, d-, f-орбитали. Они характеризуют область пространства, в которой электрон находится с наибольшей вероятностью.
Энергетические уровни
Энергетические уровни – это дискретные значения энергии, на которых могут находиться электроны в атоме. Каждый энергетический уровень имеет определенную энергию, которая определяет положение электрона в атоме.
Энергетические уровни в атоме обозначаются числами n=1, 2, 3, и т.д., где n – главное квантовое число. Уровень с наименьшей энергией имеет значение n=1 и называется первым энергетическим уровнем. Уровни с более высокой энергией имеют значения n=2, 3, и так далее.
Каждый энергетический уровень может содержать несколько электронных орбиталей. На первом энергетическом уровне находится только одна орбиталь, обозначаемая как 1s. На втором энергетическом уровне находятся орбитали 2s и 2p. На третьем энергетическом уровне находятся орбитали 3s, 3p и 3d, и так далее.
Энергетические уровни и орбитали определяют возможные места нахождения электронов в атоме. Каждая орбиталь может содержать не более двух электронов, которые должны иметь противоположные спины (спин – это внутреннее свойство электрона, которое можно представить как его вращение вокруг своей оси).
Заполнение энергетических уровней электронами происходит в соответствии с правилом заполнения электронных оболочек. Это правило гласит, что электроны заполняют оболочки и орбитали с наименьшей энергией в первую очередь.
Энергетические уровни и их заполнение электронами играют важную роль в химических свойствах элементов и их способности образовывать химические связи.
Правило заполнения электронных оболочек
Правило заполнения электронных оболочек описывает порядок, в котором электроны заполняют энергетические уровни и орбитали в атоме. Это правило основано на принципах квантовой механики и помогает объяснить химические свойства элементов и их способность образовывать химические связи.
Принцип заполнения энергетических уровней
Согласно этому принципу, электроны заполняют энергетические уровни в порядке возрастания их энергии. Наиболее близкий к ядру энергетический уровень имеет наименьшую энергию, а самый дальний от ядра – наибольшую энергию.
Принцип заполнения орбиталей
Орбитали – это области пространства, в которых существует вероятность обнаружить электрон. Существуют различные типы орбиталей, такие как s, p, d и f, которые имеют разную форму и ориентацию в пространстве.
Согласно принципу заполнения орбиталей, электроны заполняют орбитали одного энергетического уровня по одному, прежде чем начать заполнять орбитали следующего уровня. Это означает, что сначала заполняются орбитали s, затем p, d и f.
Принцип заполнения орбиталей одного типа
Если уровень энергии позволяет, орбитали одного типа заполняются по принципу “по одному электрону на каждую орбиталь, прежде чем начать заполнять орбитали с двумя электронами”. Это называется принципом Паули.
Например, орбиталь s может содержать максимум 2 электрона, поэтому первые два электрона заполняют орбиталь s, а третий электрон переходит на следующий уровень энергии и заполняет орбиталь p.
Принцип заполнения орбиталей с двумя электронами
Когда орбиталь имеет возможность вместить два электрона, они заполняются с противоположным спином (один электрон с “вверх” спином и один с “вниз” спином). Это называется принципом Гунда.
Например, орбиталь p может содержать максимум 6 электронов, поэтому первые два электрона заполняют орбиталь p с противоположным спином, а оставшиеся четыре электрона заполняют остальные орбитали p с таким же принципом.
Эти принципы заполнения электронных оболочек помогают объяснить порядок заполнения электронами их энергетических уровней и орбиталей в атоме.
Число электронов на электронных оболочках атомов
Подумаем над таким вопросом. Почему полностью заполненные электронные оболочки атомов имеют не любое количество электронов, а только определенное число электронов. А именно, эти числа равны 2, 8, 18, 32, 50 и т.д. Это число вычисляется по формуле 2N 2 , где N, это номер оболочки, если считать первой оболочкой оболочку K, второй оболочку L, третьей — M и т.д.
Как известно, в периодах периодической таблицы Менделеева идет возрастание числа электронов на электронных оболочках атомов. Причем это возрастание происходит не обязательно на внешних электронных оболочках. При увеличении атомного номера число электронов может увеличиваться на внутренних оболочках атома.
Так как электроны отталкиваются друг от друга, то они на одной оболочке всегда размещаются на поверхности сферы на максимальных расстояниях друг от друга. Если бы у атома была бы только одна электронная оболочка, то на поверхности сферы электроны размещались бы в вершинах правильных многогранников. Тогда их число в полностью заполненной электронной оболочке было бы такое: 2 (отрезок), 3 (правильный треугольник), 4 (тетраэдр), 6 (октаэдр), 8 (куб) , 20 (додекаэдр) и 12 (икосаэдр).
Но у электронов, кроме степеней свободы в пределах сферы, есть и радиальная степень свободы. Причем, притяжение электрона к ядру атома не влияет на распределение электронов по сфере, но существенно влияет на радиальное распределение электронов. Поэтому, когда мы пытаемся разместить на сфере третий электрон, то третьему электрону энергетически выгоднее выскочить из этой сферы на сферу с большим радиусом.
Энергия его взаимодействия с ядром, конечно же, увеличивается, так как увеличивается расстояние до ядра. Но зато уменьшается энергия его взаимодействия с двумя другими электронами, так как увеличивается среднее расстояние между ним и этими электронами. Плюс к этому уменьшается энергия взаимодействия двух электронов на внутренней оболочке, так как они раздвигаются на сфере в максимально удаленные точки. Наконец, радиус внутренней электронной оболочки слегка уменьшается за счет отталкивания двух электронов от электрона на внешней оболочке.
Затем, если наращивать количество электронов на внешней оболочке снова до числа три, то третий электрон уже не выскакивает со второй оболочки на третью, так как ситуация кардинально изменилась тем, что имеется внутренняя оболочка с двумя электронами. Энергетический проигрыш оказывается в этом случае больше, чем энергетический выигрыш для любого радиуса пятого электрона (2 электрона на внутренней оболочке и 3 на внешней).
Но вторая оболочка не может заполняться сколь угодно большим числом электронов. Рано или поздно возникнет такая ситуация, когда очередному добавленному электрону будет выгоднее начать образовывать третью оболочку. Почему же эта ситуация возникает только после того, как на второй оболочке будет 8 электронов, а не два и не четыре и не шесть?
Дело в том, что электроны внешней электронной оболочки подстраиваются под симметрию внутренней электронной оболочки. А внутренняя оболочка не подстраивается под внешнюю, так как энергия связи выше внутренней оболочки с ядром больше, чем энергия связи внешней оболочки с ядром атома. Другими словами, внутренняя оболочка оказывает гораздо большее влияние на внешнюю электронную оболочку, чем внешняя на внутреннюю по сравнению со средней энергией взаимодействия оболочки с ядром атома.
В связи с этим на второй оболочке получается не 4 электрона (тетраэдр) , а 8 (куб). Ведь отрезок из двух электронов вписывается в треугольник и в тетраэдр с группой симметрии меньшего порядка, чем он может вписаться в куб. (Сам куб при этом, конечно же, слегка деформируется в вытянутый параллелепипед.)
Подобными симметрийными соображениями объясняются и другие другие числа электронов на других оболочках.
- Классика:
- Хаос
- Колебания
- Энтропия
- Квантовая физика:
- Спин
- Электронные оболочки
- Обменное взаимодействие
- Магнетизм:
- Магнетизм
- Изолятор поля магнита
- Астрофизика:
- Нейтронные звезды
- Миф о черной дыре
- Миф о парадоксе близнецов
Электрон и электронная оболочка атома
Атом, который в целом является нейтральным, состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки (электронное облако), при этом, суммарные положительные и отрицательные заряды равны по абсолютной величине. При вычислении относительной атомной массы массу электронов не учитывают, так как она ничтожно мала и в 1840 раз меньше массы протона или нейтрона.
Электрон – совершенно уникальная частица, которая имеет двойственную природу: он имеет одновременно свойства волны и частицы. Они непрерывно движутся вокруг ядра.
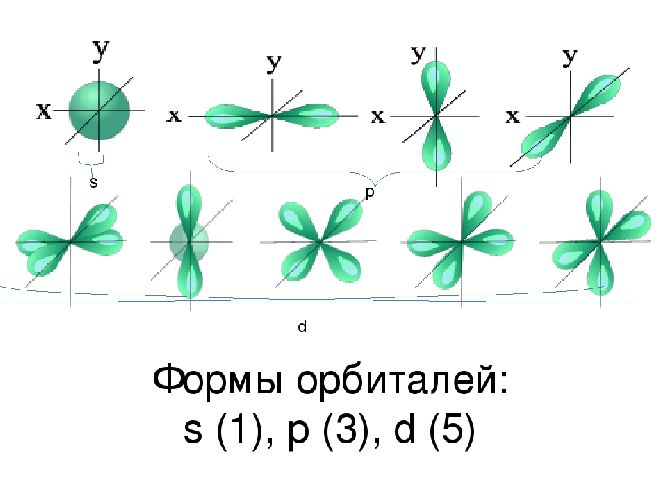
Пространство вокруг ядра, где вероятность нахождения электрона наиболее вероятна, называют электронной орбиталью, или электронным облаком. Это пространство имеет определенную форму, которая обозначается буквами s-, p-, d-, и f-. S-электронная орбиталь имеет шаровидную форму, p-орбиталь имеет форму гантели или объемной восьмерки, формы d- и f-орбиталей значительно сложнее.
Вокруг ядра электроны расположены на электронных слоях. Каждый слой характеризуется расстоянием от ядра и энергией, поэтому электронные слои часто называют электронными энергетическими уровнями. Чем ближе уровень к ядру, тем меньше энергия электронов в нем. Один элемент отличается от другого числом протонов в ядре атома и соответственно числом электронов. Следовательно, число электронов в электронной оболочке нейтрального атома равно числу протонов, содержащимся в ядре этого атома. Каждый следующий элемент имеет в ядре на один протон больше, а в электронной оболочке – на один электрон больше.
Вновь вступающий электрон занимает орбиталь с наименьшей энергией. Однако максимальное число электронов на уровне определяется формулой:
где N – максимальное число электронов, а n – номер энергетического уровня.
На первом уровне может быть только 2 электрона, на втором – 8 электронов, на третьем – 18 электронов, а на четвертом уровне – 32 электрона. На внешнем уровне атома не может находится больше 8 электронов: как только число электронов достигает 8, начинает заполняться следующий, более далекий от ядра уровень.
Строение электронных оболочек атомов
Каждый элемент стоит в определенном периоде. Период – это горизонтальная совокупность элементов, расположенных в порядке возрастания заряда ядер их атомов, которая начинается щелочным металлом, а заканчивается инертным газом. Первые три периода в таблице – малые, а следующие, начиная с четвертого периода – большие, состоят из двух рядов. Номер периода, в котором находится элемент имеет физический смысл. Он означает, сколько электронных энергетических уровней имеется в атоме любого элемента данного периода. Так, элемент хлор Cl находится в 3 периоде, то есть его электронная оболочка имеет три электронных слоя. Хлор стоит в VII группе таблицы, причем в главной подгруппе. Главной подгруппой называется столбец внутри каждой группы, который начинается с 1 или 2 периода.
Таким образом, состояние электронных оболочек атома хлора таково: порядковый номер элемента хлора – 17, что означает, что атом имеет в ядре 17 протонов, а в электронной оболочке – 17 электронов. На 1 уровне может быть только 2 электрона, на 3 уровне – 7 электронов, так как хлор находится в главной подруппе VII группы. Тогда на 2 уровне находится:17-2-7=8 электронов.