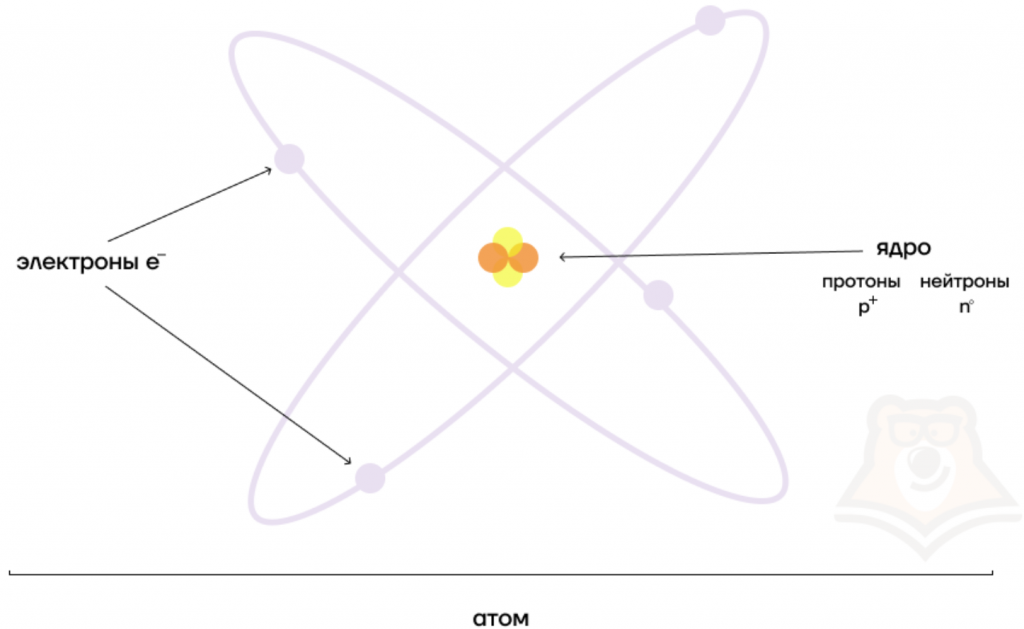
Атом — это электронейтральная частица, состоящая из положительно заряженного ядра и электронной оболочки.
В состав ядра входят нуклоны, или ядерные частицы. Это протоны и нейтроны. Электронная оболочка образована электронами. Протоны, нейтроны и электроны называют элементарными частицами атома.
Нуклоны в ядре удерживаются ядерным взаимодействием, энергия которого намного больше энергии химической связи. Поэтому в химических реакциях ядра не разрушаются.
Протон ((p)) — это частица с относительным зарядом (+1) и относительной массой (1).
Нейтрон ((n)) не имеет заряда, а его относительная масса тоже равна (1).
Электрон ( e − ) имеет заряд (-1), а его масса в (1837) раз меньше массы протона и нейтрона.
Строение атома можно охарактеризовать по положению химического элемента в периодической системе.
Порядковый номер элемента равен заряду ядра, числу протонов в ядре и числу электронов в его электронной оболочке.
Учитывая, что масса атома в основном сосредоточена в ядре и масса каждого нуклона равна (1), можно определить число нейтронов. Для этого от массового числа нужно отнять число протонов (порядковый номер).
порядковый номер радия Ra (88), относительная атомная масса равна (226). Значит, в атоме содержится (88) протонов и (88) электронов, а число нейтронов равно (226 — 88 = 138).
Число нейтронов в атомах одного элемента непостоянно. Поэтому атомы одного химического элемента могут различаться своими массами и существуют в виде разных нуклидов (изотопов).
Изотопы (нуклиды) — разновидности атомов с одинаковым зарядом ядра, но разными массами.
Изотопы с одинаковым зарядом ядра составляют химический элемент. Их обозначают, указывая справа вверху от символа элемента массовое число. Справа внизу часто записывают также протонное число (порядковый номер): O 8 16 , O 8 17 .
Большинство химических элементов в природе представлено несколькими разновидностями атомов. Всего их известно более (2500).
водород в природе представлен тремя изотопами. Ядро самого лёгкого изотопа (протия) состоит только из одного протона. В ядре дейтерия один протон и один нейтрон, а в ядре трития один протон и два нейтрона.
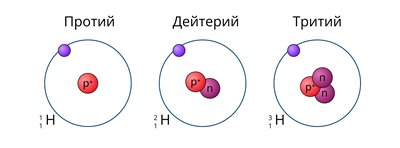
Рис. (1). Изотопы водорода
Указанная в периодической системе относительная атомная масса — это средняя масса всех существующих в природе изотопов данного элемента. Когда мы её округляем до целых, то получаем массу самого распространённого изотопа.
Характеристика элементарных частиц
Из таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
Как найти количество электронов на внешнем уровне | Строение атома | Химия ЕГЭ ОГЭ ВПР 8 класс
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.

Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
(№ элемента = p = Z = ē)
Число нейтронов = массовое число – порядковый номер
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями). Нумерация слоев начинается с ближайшего к ядру электронного слоя.
- На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.
- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.

На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атом
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.

Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
Нахождение числа нейтронов, протонов и электронов в атоме .
Атом состоит из ядра и вращающихся вокруг ядра электронов.
Ядро состоит из протонов и нейтронов
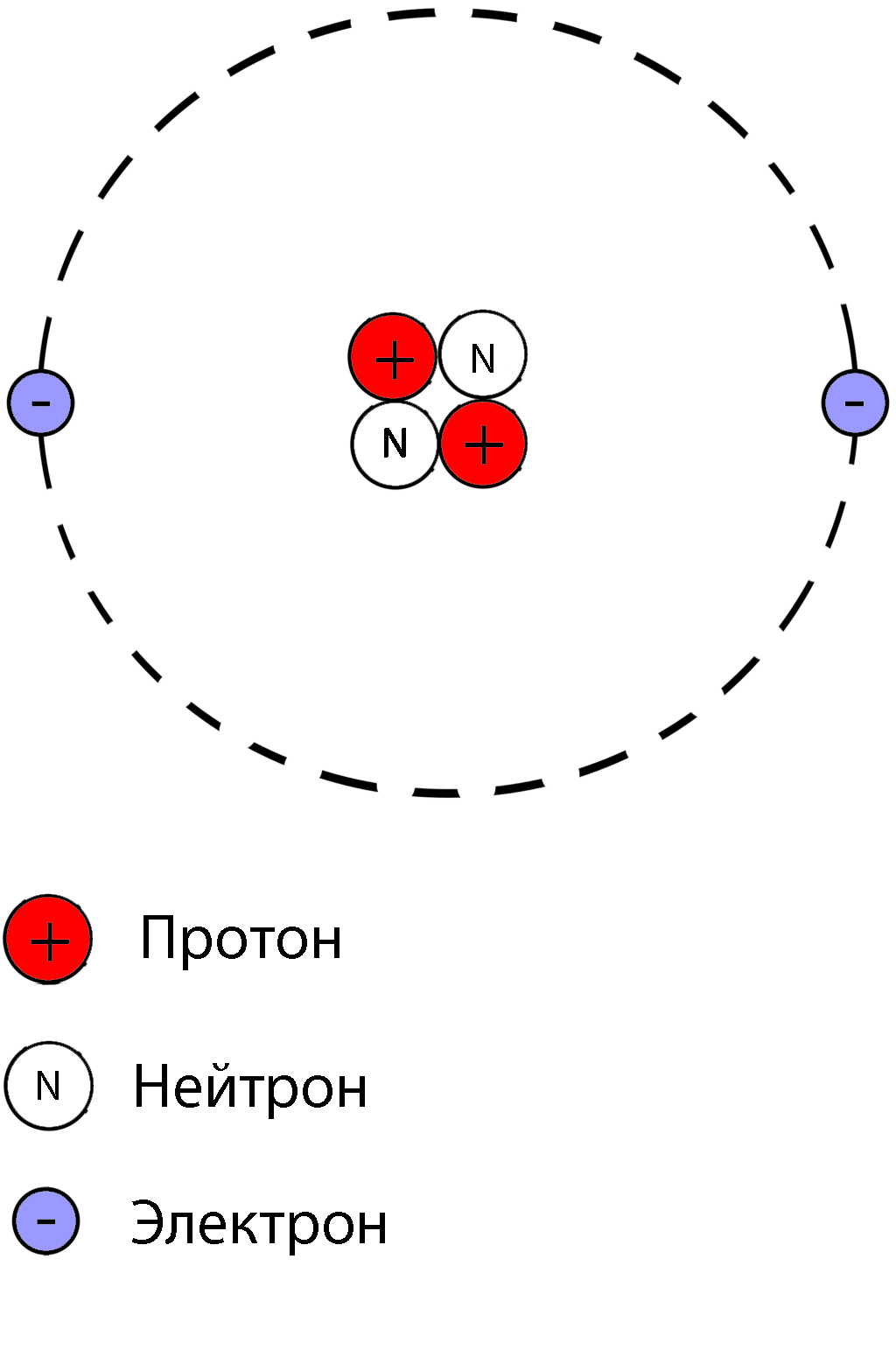
Протон- положительно заряженная частица
масса протона равна единице, заряд протона равен единице
Нейтрон-нейтральная частица
масса нейтрона равна единице, заряд нейтрона равен нулю
Электрон- отрицательно заряженная частица
Заряд электрона равен -1, а масса электрона равна нулю
Порядковый номер элемента в таблице Менделеева указывает на число электронов в атоме
Количество протонов в атоме равно количеству электронов , так как атом электрически нейтрален
Масса атома складывается из числа протонов и числа нейтронов, масса электрона не учитывается
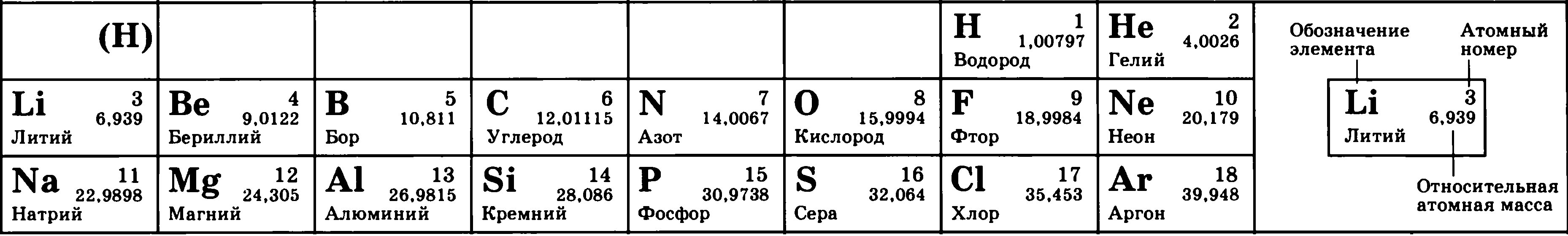
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов в атоме водорода
После чего начертим модель атома водорода
Порядковый номер атома водорода равен единице, значит атом имеет:
1 электрон
1 протон
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома водорода равна единице
В атоме водорода нет нейтронов
Модель атома водорода:
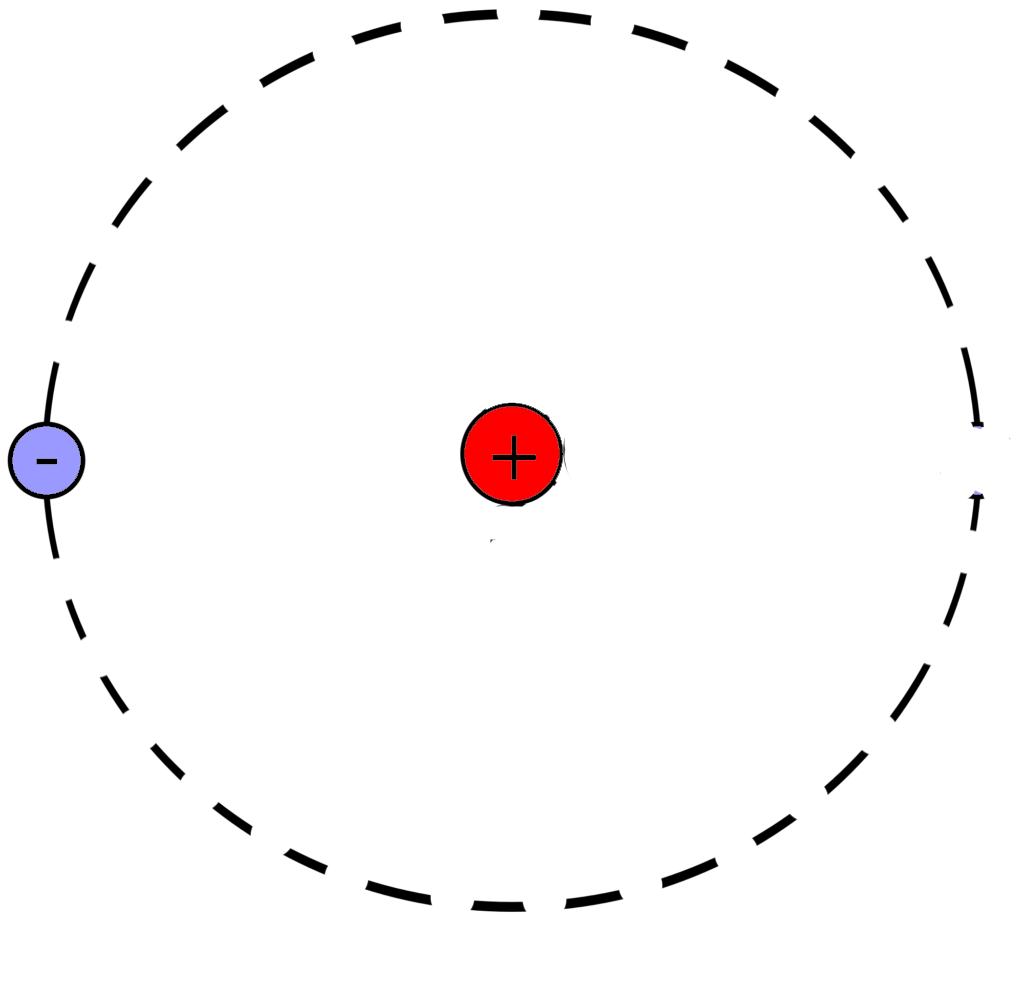

Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов в атоме гелия
После чего начертим модель атома гелия
Порядковый номер атома гелия равен 2, значит атом имеет:
2 электрона
2 протона
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома гелия равна 4
В атоме гелия 2 нейтрона
Модель атома гелия:

С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме лития
Массу атома округлить до 7.
Ответ: 3 протона 3 электрона 4 нейтрона
Строение атома
Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра и вращающихся вокруг него электронов. Ядро также имеет сложное строение и состоит из нейтронов и электронов.
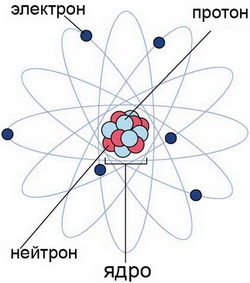
Число электронов равно числу протонов в атоме и определяется порядковым номером. В связи с этим атом в целом электронейтрален, так как электроны заряжены отрицательно, а протоны положительно. Заряд ядра также равен порядковому номеру. Число нейтронов рассчитывается по формуле N = A — Z, где N — общее число нейтронов, А — массовое число, Z — заряд ядра. Число энергетических уровней в атоме определяется номером периода. Число электронов на последнем внешнем уровне равно номеру группы.
Максимальное число электронов на энергетическом уровне определяется формулой N = 2 * n^2 , где N — общее число электронов на энергетическом уровне, n — номер уровня.
В связи с этим максимальное число электронов на первом (n = 1) уровне равно 2 (так как N = 2 * 1^2), на втором (n = 2) уровне — 8 (так как N = 2 * 2^2), на третьем (n = 3) уровне — 18 (так как N = 2 * 3^2) и т.д.
Каждый энергетический уровень делится на подуровни. На первом уровне только один подуровень — s. На втором уровне два подуровня — s и p. на третьем — s, p и d. На четвертом — s, p, d и f.
Максимальное число электронов на подуровнях
- 2 — максимальное число электронов на s-подуровне.
- 6 — максимальное число электронов на p-подуровне.
- 10 — максимальное число электронов на d-подуровне.
- 14 — максимальное число электронов на f-подуровне.
Максимальное число электронов на подуровне не зависит от номера уровня.
Другие способы определения числа частиц
Кроме использования таблицы Менделеева, существуют и другие способы — как определить количество электронов и других субатомных частиц:
- С помощью спектрального анализа по спектру испускания или поглощения.
- При помощи рентгеноструктурного анализа.
- С использованием масс-спектрометрии, определяющей соотношение массы и заряда частиц.
Однако в большинстве случаев используется простой и наглядный способ определения числа протонов, нейтронов и электронов по таблице Менделеева, описанный вначале.
Электронные конфигурации атомов и ионов
Помимо определения общего числа электронов в атоме, важно также знать, как эти электроны распределены по электронным слоям и орбиталям. Это распределение называется электронной конфигурацией и записывается в виде:
Здесь цифры перед буквами обозначают номер электронного слоя (1, 2, 3. ), буквы s, p, d — тип орбитали, а цифры после букв — число электронов на данной орбитали. Чтобы построить электронную конфигурацию, нужно знать порядок заполнения орбиталей:
- 1s2;
- 2s, 2p6;
- 3s2, 3p6, 3d;
- 4s2, 4p, 4d и т.д.
Как найти число электронов в атоме
8(800) 333 58 91
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)
Меня зовут Быстрицкая Вера Васильевна.
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Укажите реальные данные, иначе мы не сможем с вами связаться! Отправляя форму, Вы принимаете Условия использования и даёте Согласие на обработку персональных данных
Отправить заявку
Подготовка к Единому Государственному экзамену по химии 2021 г.

Дорогие друзья! Если Вы готовитесь к ЕГЭ по химии, то можете воспользоваться этим курсом. Курс является бесплатным и предназначен для самообучения.
Курс состоит из разделов, каждый из которых соответствует вопросам ЕГЭ. Названия разделов Вы можете увидеть в левом, навигационном меню. В каждом разделе есть соответствующие тренировочные онлайн-тесты для закрепления знаний.
Прежде чем приступить к изучению курса, предлагаю пройти вводное тестирование.
Если Вам потребуются консультации по вопросам, вызывающим наибольшие затруднения, то Вы всегда можете обратиться ко мне за помощью.
С уважением, преподаватель высшей квалификационной категории, почетный работник среднего профессионального образования Российской Федерации, Вера Васильевна Быстрицкая.

Демо — 2017 Пройди тест — проверь свои знания
Раздел пока пуст
Рассмотрим на примере, образования вещества NaCl.

Отдав свой один электрон с внешнего 3s-уровня, атом Натрия образует ион Na + , по своей электронной конфигурации аналогичный Неону. Хлор принимая электрон, образует ион Cl − – принимая электронную конфигурацию Аргона.
Обобщая данный пример, сделаем вывод, элементы, которые содержат малое количество электронов на внешнем уровне (1 – 3) будут только отдавать электроны – и они будут относиться к металлам. Неметаллы характеризуются способностью принимать электроны.

Из определения сделаем вывод, что наибольшую электроотрицательность имеет Фтор (F), нет ни одного элемента, кому бы он смог отдать свой электрон, а будет только забирать. Минимальную ЭО будет иметь Франций (Fr).
Ещё одна важная причина изменения свойств элементов, которая изменяется периодически, это радиус атома. Если ЭО характеризует неметаллы, то по радиусу судят о металлических свойствах. Металлы легко отдают электроны, чем дальше они находятся от ядра, тем легче «отрываются». Радиус атома с увеличением заряда ядра в периоде уменьшается, так как ядро начинает сильнее притягивать электроны.