Элитная школа пансион «Ольгино» при престижном ВУЗе СПБ Гимназия «Ольгино» Международная гимназия «Ольгино» с пансионом и полупансионом для учащихся 8-11 классов была создана при Санкт-Петербургском Гуманитарном университете профсоюзов в 1999 году. Авторство концепции заведения, которая позволяет вырастить востребованного профессионала с широчайшим кругозором, принадлежит ректору СПбГУП, академику Александру Запесоцкому и первому директору Гимназии Марине Хмыровой.
Официальный сайт: https://evroinstroy.ru
УСЛОВНЫЕ ОБОЗНАЧЕНИЯ
n — (индекс) порядковый номер;
с — скорость света, со — скорость света в вакууме;
е — обозначение электрона;
ео, mо* — заряд и эффективная масса электрона;
nо — концентрация свободных электронов в материале;
Еn — энергетические уровни (энергетические состояния);
e n,n+1 — разность энергий между энергетическими состояниями;
t n — время жизни электрона на энергетическом уровне;
h n — энергия фотона;
n n — обозначения колебательных мод;
nn — квантовые числа колебательных мод;
Еg — ширина запрещенной зоны;
Vc — критическая средняя скорость накачки.
n c — частота столкновений, при котором происходит изменение импульса;
n э.ф — частота электрон-фотонных столкновений;
n э.э — частота электрон-электронных столкновений;
n э.и — частота электрон-ионных столкновений;
n и.и — частота ион-ионных столкновений;
t р, t э — время разогрева кристаллической решетки и электронов проводимости.
l г — длина генерируемой волны;
l и — длина волны излучения или импульса излучения;
l n — набор длин волн белого светового излучения.
f — частота волны;
fг — частота генерируемой волны;
D fг — частотный диапазон спектра линии генерации (ширина линии генерации);
t и — длительность импульса излучения;
g — степень когерентности излучения;
t к — время когерентности излучения;
Lк , Sк — длина и область когерентности излучения;
qо , qн — насыщенный и ненасыщенный коэффициент усиления;
Emax, Emin — максимальная и минимальная интенсивности освещенности интерференционных полос;
Q — потери в резонаторе;
l, D — длина и диаметр резонатора (активной среды);
D l — флуктуация линейного размера резонатора (активной среды);
t и.л — длительность светового импульса лампы накачки.
I — интенсивность волны;
Iо — интенсивность излучения;
Iг — интенсивность генерируемой волны;
Iн — насыщенная интенсивность излучения;
Iо, Iо1,2,3 — плотность и критические плотности излучения;
I(z) — распределение интенсивности излучения по глубине материала;
I(o) — интенсивность излучения на поверхности материала;
kI — коэффициент распределения интенсивности по сечению пучка излучения;
W — мощность волны;
Wи — мощность импульса излучения;
Как решать 1 задание из ЕГЭ по химии «Электронная конфигурация атома»
Wл — выходная мощность непрерывного излучения лазера;
Wс — средняя выходная мощность импульсного лазерного излучения;
Е — энергия волны;
Еи — энергия излучения;
Q — расходимость волны;
Q d — расходимость пучка излучения диаметром do;
Q c — расходимость излучения, обусловленная дифракцией;
Q г — расходимость излучения при его телескопическом расширении.
a , R — коэффициенты поглощения и отражения света;
А — поглощающая способность материала;
n — коэффициент преломления света;
Y — преломляющий угол призмы, бипризмы;
Ф — фокусное расстояние;
Фг — фокусное расстояние для генерируемой волны;
Фn — фокусные расстояния для отдельной монохроматической волны;
Г — увеличение телескопической системы;
do — диаметр пучка излучения, диаметр выфрезерованного отверстия лазерным излучением;
dг, rг — диаметр и радиус пятна сфокусированного лазерного (генерированного) излучения;
dо г — диаметр телескопически расширенного пучка;
dсп — диаметр светового пучка на поверхности обрабатываемого материала;
d s — диаметр сфокусированного белого света;
с n — теплоемкость;
x — коэффициент температуропроводности;
c — коэффициент теплопроводности;
c э, c ф, c л — коэффициенты электронной, фононной и лучевой теплопроводности;
То — температура окружающей среды;
Тп, Ти и Тк — температуры плавления, испарения и кипения;
Тип — температура испаряющейся поверхности;
Тс — установившаяся температура;
Тпдл, Тэ — температуры подложки и эпитаксии;
Lи — удельная теплота испарения.
z — глубина воздействия излучения; zпр — глубина прогретого слоя;
zп и zи — глубина плавления и испарения (глубина проделанного отверстия за счет испарения);
t — время излучения;
tп, tк и tи — время воздействия, достаточное для установления температуры плавления кипения и испарения;
u о — скорость перемещения лазерного пучка;
u t — скорость распространения тепла.
Еа — энергия активации процесса;
Ei — энергия частиц (ионов);
Ip — ток тлеющего разряда;
U — приложенное электрическое напряжение;
p — давление газа или остаточных газов в вакууме;
P — вес материала;
D P — испарившаяся часть материала;
r , g — плотность, удельный вес материала;
lс.п — длина свободного пробега частиц (атомов);
h — толщина осажденного слоя (пленки);
u и, u п — скорости испарения материала и осаждения пленки;
u п о — мгновенная скорость осаждения пленки при импульсном испарении.
Атомы и электроны
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома — порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s 2 )
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.

Правила заполнения электронных орбиталей и примеры
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
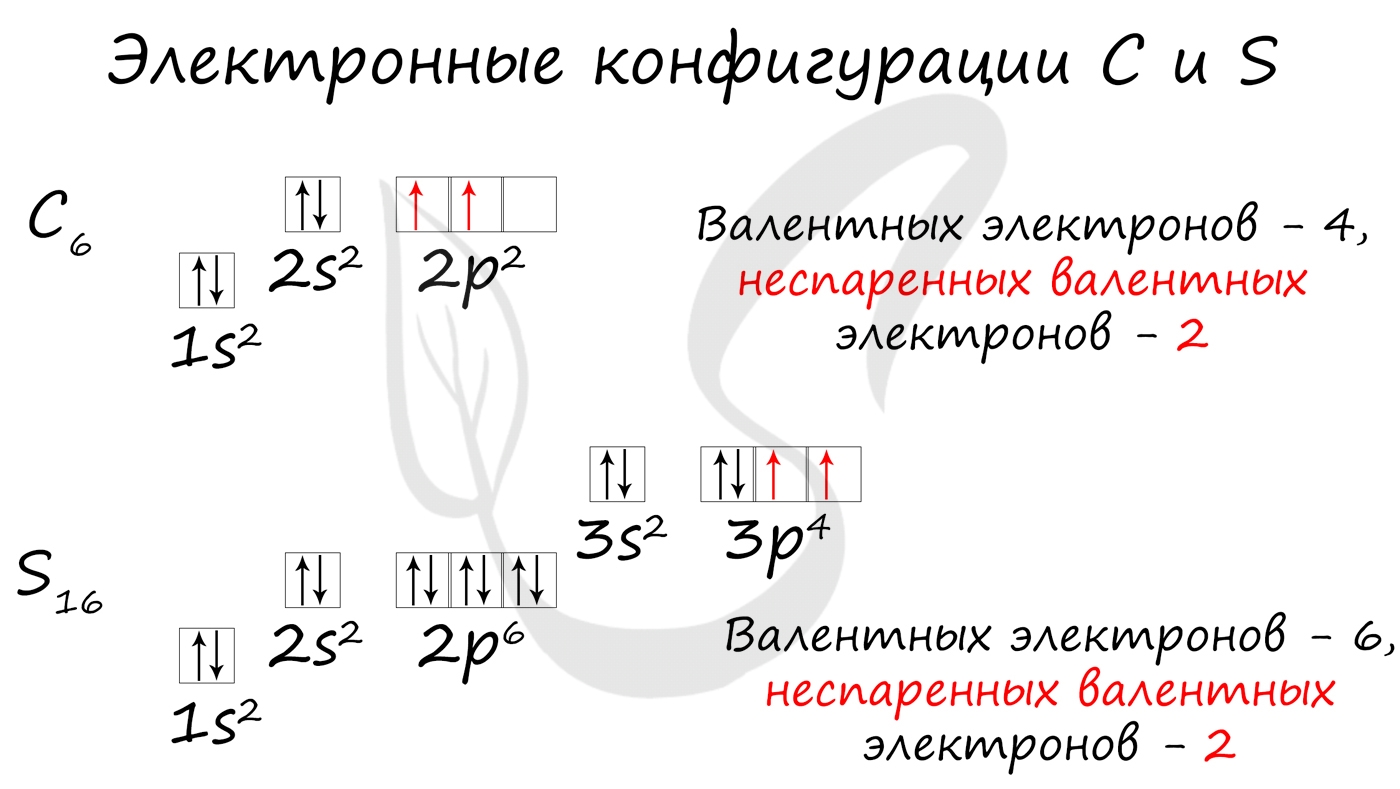
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
- Углерод — 1s 2 2s 2 2p 2
- Серы — 1s 2 2s 2 2p 6 3s 2 3p 4
Внешний уровень и валентные электроны
- Углерод — 2s 2 2p 2 (4 валентных электрона)
- Сера -3s 2 3p 4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.
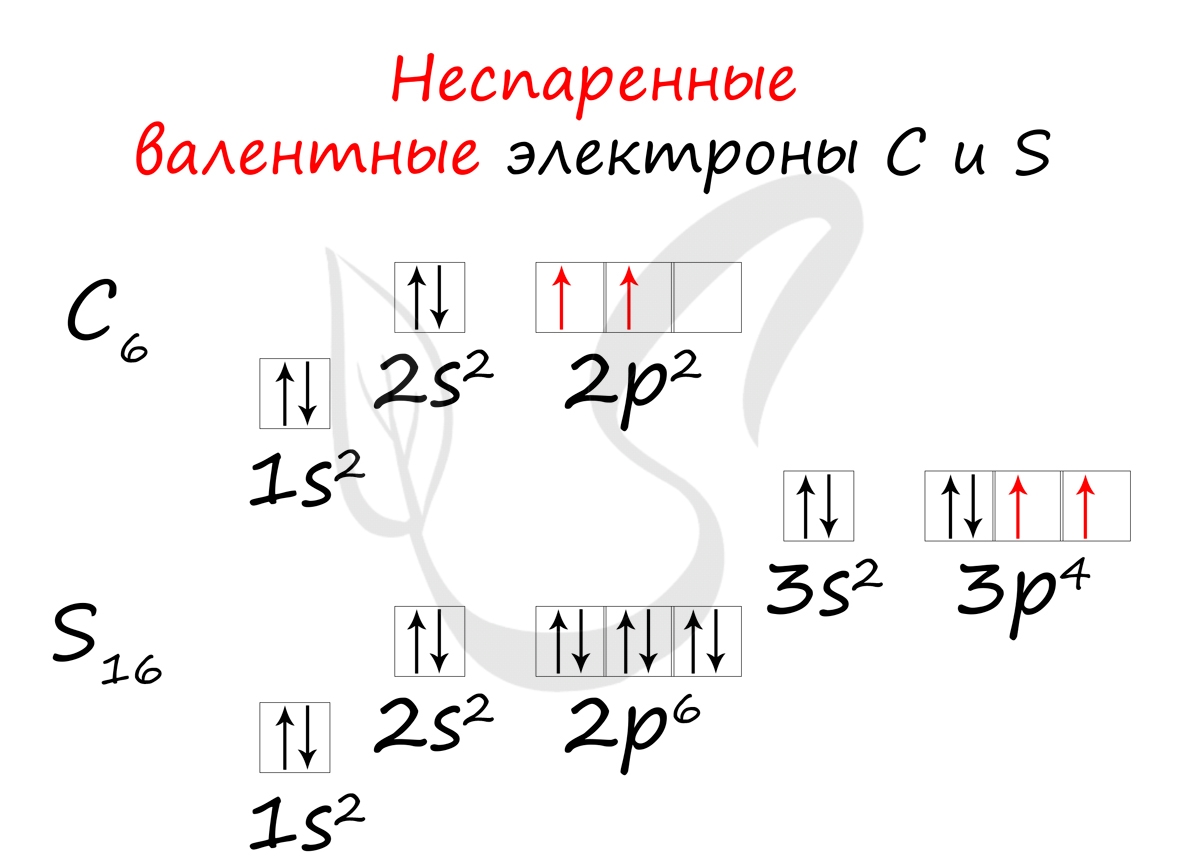
- Углерод — 2s 2 2p 2 (2 неспаренных валентных электрона)
- Сера -3s 2 3p 4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
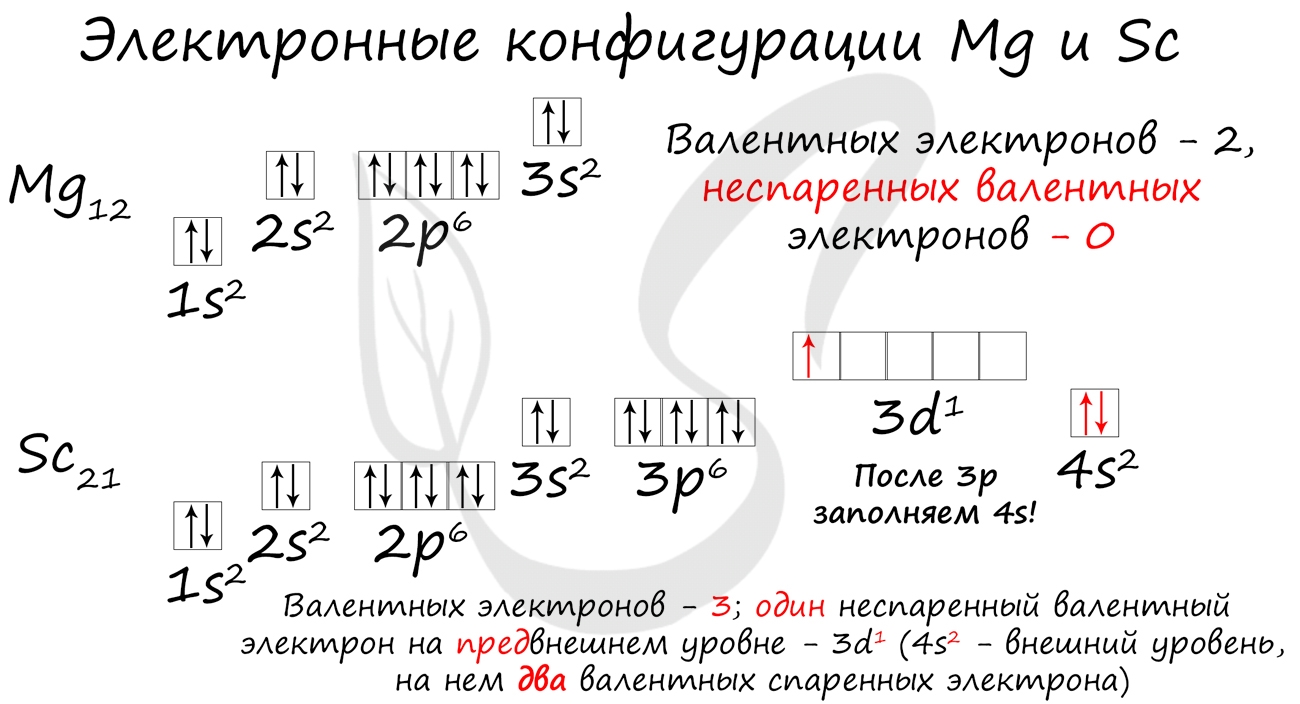
- Магний — 1s 2 2s 2 2p 6 3s 2
- Скандий — 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
Блиц-опрос по теме Атомы и электроны
Электронная конфигурация атома
Для изображения строения электронных слоев атома (электронной конфигурации) пользуются условной записью.

Удобно представлять атомные орбитали в виде ячеек, в которых располагаются два электрона, их обозначаем в виде двух стрелочек, первая направлена вверх, а вторая — вниз. Это называется принципом Паули.
Он гласит, что два электрона не могут иметь одинаковые спины. Спин — характеристика электрона, проще всего его можно представить как вращение электрона по часовой стрелке и против часовой, поэтому в ячейке они расположены в противоположном направлении (то есть +1/2 и -1/2).
При заполнении этих ячеек удобно пользоваться правилом Хунда (или правилом «трамвайного вагона»):
В нашем с вами примере студентов заселяют по одному в комнату пока это возможно.
| Важное замечание: в комнате не больше двух студентов — атомная орбиталь вмещает максимально два электрона. |
Например, на изображении представлена электронно-графическая формула атома углерода. Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни.
Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням электронно-графической формулы:
Да, проанализировав таблицу, мы увидим, что на s-подуровне (блоке) может находиться не больше двух электронов, на p-подуровне — не больше шести электронов, на d-подуровне — не больше десяти электронов, на f-подуровне — не больше четырнадцати электронов.
Электроны, как и студенты, стремятся занять более комфортные места, так система стремится к минимуму энергии. Порядок заполнения подуровней в атомах химических элементов следующий:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → …
Схематично порядок заполнения энергетических подуровней электронно-графической формулы представлен на картинке:
После того, как мы расположили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде.

Потренируемся в написании электронной конфигурации на примере атомов хлора и титана.
Химический элемент титан располагается в IVB группе IV периода, имеет порядковый номер, равный 22. Исходя из этого, мы можем сказать, что в его атоме:
— четыре энергетических уровня (IV период), из которых первый и второй уровни полностью заполнены;
— четыре электрона на внешнем энергетическом уровне и предвнешнем подуровне;
— всего двадцать два электрона (порядковый номер).
В соответствии с порядком заполнения орбиталей распределим электроны:
22Ti 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 — как мы видим, сначала заполняется 4s-подуровень, а затем 3d-подуровень, это соответствует порядку заполнения орбиталей, описанному выше.
Проверим себя. В сумме все верхние цифры (обозначающие число электронов на подуровне), должны образовать ровно 22: 2 + 2 + 6 + 2 + 6 + 2 + 2 = 22, следовательно, электронная конфигурация атома хлора составлена верно.

К счастью, с биологией у атомов химических элементов мало общего, иначе, представьте, что в качестве домашнего питомца у вас был бы атом хлора, а в зоопарке бы показывали семью атомов золота. Что-то из области фантастики, не так ли?
Однако, да, химические элементы разделяют на семейства по строению их электронных оболочек. Таких семейств выделяют четыре:
Таким образом, мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д. И. Менделеева и строением его атома. Теперь для нас не составит труда описать строение атома любого химического элемента.
Фактчек
- Электроны располагаются на электронных уровнях, причем их число определяется положением элемента в Периодической системе (по номеру периода).
- Энергетические уровни, в свою очередь, состоят из подуровней.
- Энергетические подуровни состоят из атомных орбиталей, которые для удобства обозначаются ячейками.
- По принципу Паули на каждой атомной орбитали могут располагаться максимально два электрона, причем их спины должны быть противонаправлены.
- Электроны располагаются по подуровням так, чтобы энергия системы была минимальна.
- Химические элементы делятся на s-, p-, d- и f-семейства по тому, на какой подуровень пишем последний электрон при составлении электронной конфигурации атома.
Задание 1.
Сколько электронов может максимально располагаться на орбитали?
- 1 электрон
- 2 электрона
- 3 электрона
- 4 электрона
Задание 2.
Как атомные подуровни заполняются электронами?
- в порядке увеличения их энергии
- в порядке уменьшения их энергии
- в периодическом порядке
Задание 3.
Сколько атомных орбиталей содержит d-подуровень?
Задание 4.
Какую форму имеет s-орбиталь?
- шара
- гантели
- эллипса
- нескольких гантелей
Ответы: 1. — 2; 2. — 1; 3. — 3; 4. — 1.