2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
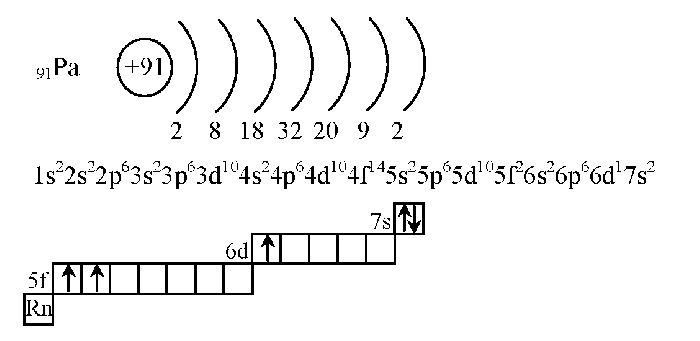
Электронная оболочка атома
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не превышает определенного максимального значения.
Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра, что делает их более важными в анализе поведения атома в химических реакциях и в роли проводника, так как их связь с ядром слабее и легче разрывается
Валентная оболочка— самая внешняя оболочка атома. Электроны этой оболочки зачастую неверно называют валентными электронами, то есть электронами, определяющими поведение атома в химических реакциях. С точки зрения химической активности, наименее активными считаются атомы, в которых валентная оболочка окончательно заполнена (инертные газы). Наибольшей химической активностью обладают атомы, в которых валентная оболочка состоит всего из одного электрона (щелочные металлы), и атомы, в которых одного электрона не хватает для окончательного заполнения оболочки (галогены).
На самом деле всё немного иначе. Поведение атома в химических реакциях определяют электроны, обладающие большей энергией, то есть те электроны, которые расположены дальше от ядра. Электроны внутренних подуровней оболочек имеют меньшую энергию, чем электроны внешних подуровней. Несмотря на то, что электроны подуровня оболочки 3d могут не принадлежать к т. н. валентной оболочке, они могут иметь энергию большую, чем электроны подуровня оболочки 4s, что делает их валентными электронами.
?. Вопросы и задания
1. Изобразите схемы строения электронной оболочки атомов: а) алюминия; б) фосфора; в) кислорода.
2. Сравните строение электронной оболочки атомов: а) азота и фосфора; б) фосфора и серы.
а) Азот и фосфор.
N +7 $)_)_$
$^<>_N$ $2e^,5e^$
$1s^2s^2p^$
P +15 $)_)_)_$
$^<>_P$ $2e^,8e^,5e^$
$1s^2s^2p^3s^3p^$
У фосфора больше заряд ядра. Оба атома содержат по 5 электронов на последнем энергетическом уровне. Строение электронной оболочки этих атомов схоже, однако у азота всего 2 энергетических уровня, а у фосфора их 3.
б) Фосфор и сера.
Нуклиды. Изотопы. Массовое число атома. Урок 17. Химия 8 класс
P +15 $)_)_)_$
$^<>_P$ $2e^,8e^,5e^$
$1s^2s^2p^3s^3p^$
S +16 $)_)_)_$
$^<>_S$ $2e^,8e^,6e^$
$1s^2s^2p^3s^3p^$
Атомы фосфора и серы имеют по 3 энергетических уровня, но у фосфора на последнем энергетическом уровне 5 электронов, а у серы их 6.
3. Впишите пропущенные слова в предложения: «Атом кремния содержит в ядре . протонов и . нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов, равно . элемента. Число энергетических уровней определяется номером . и равно . . Число электронов на внешнем электронном слое определяется номером . и равно . »
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов, равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3. Число электронов на внешнем электронном слое определяется номером группы и равно 4.
4. Определите положение химического элемента в Периодической системе Д.И. Менделеева по его электронной формуле: а)$2e^, 8e^$; б)$2e^, 8e^, 4e^$.
Число электронов равно порядковому номеру элемента.
а) У этого элемента порядковый номер 10 (так как содержит 10 электронов), он располагается во 2 периоде (так как имеет 2 энергетических уровня), в главной подгруппе VIII группы (так как 8 электронов на внешнем энергетическом уровне). Это неон Ne.
б) У этого элемента порядковый номер 14 (так как содержит 14 электронов),он располагается во 3 периоде (так как имеет 3 энергетических уровня), в главной подгруппе IV группы (так как 4 электрона на внешнем энергетическом уровне). Это кремний Si.
5. Почему в 1−м периоде Периодической системы Д.И. Менделеева содержится только два элемента, а во 2−м — только восемь?
Максимальное число электронов, находящихся на энергетическом уровне, можно определить по формуле: $2n^$, где n−номер уровня. Следовательно, первый энергетический уровень максимально может содержать 2 электрона ($2 * 1^ = 2$), а второй энергетический уровень 8 электронов ($2 * 2^ = 8$). Поэтому в 1−м периоде Периодической системы Д. И. Менделеева содержится только два элемента, а во 2−м – восемь.
6. Приведите примеры периодически повторяющихся явлений, с которыми вы познакомились при изучении других учебных предметов
Примеры периодически повторяющихся явлений:
− колебания маятника;
− смена времён года;
− смена дня и ночи;
− приливы и отливы;
− биоритмы;
− лунные и солнечные затмения;
− график синусоиды.
7. Попробуйте дать собственное толкование следующих строк из стихотворения В. Брюсова «Мир электрона»:
Быть может, эти электроны −
Миры, где пять материков,
Искусства, званья, войны, троны
И память сорока веков.
Ещё, быть может, каждый атом −
Вселенная, где сто планет;
Там всё, что здесь, в объёме сжатом,
Но также то, чего здесь нет.
Электроны и строение атома были открыты в начале XX века, чуть позже было написано это стихотворение, которое отражает во многом нуклеарную, или планетарную, теорию строения атома. Автор допускает, что эта сжатая планетарная система не такая, как наша.
Также автор допускает возможность, что и электроны тоже сложные частицы, строение которых мы еще просто не изучили.
8. О каком поэтическом даре говорят приведённые выше строчки, если учесть, что стихотворение было написано в 1922 г.?
Приведенные четверостишия говорят о гибком уме В. Брюсова, раз он мог так легко понять и принять все достижения современной ему науки, а также, по всей видимости, просвещенности и образованности в данной области. У В. Брюсова был дар объяснять сложные вещи простыми словами, да еще и в стихах.
- Вы здесь:
- 8 класс
- Химия
- ГДЗ ответы к учебнику химия 8 класс, Габриелян
- ГДЗ ответы к рабочей тетради по химии 8 класс, Габриелян, Сладков, Остроумов
- ГДЗ ответы к рабочей тетради химия 8 класс, Габриелян, Сладков
- ГДЗ ответы к учебнику химия 8 класс, Рудзитис, Фельдман
- ГДЗ ответы к учебнику химия 8 класс, Габриелян, Остроумов, Сладков
Число электронов находящихся вокруг ядра как и число протонов равно
Вопрос по химии:
Число электронов,находящихся вокруг ядра , как и число протонов,равно элемента
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
- bookmark_border
- 21.08.2017 08:50
- Химия
- remove_red_eye 3679
- thumb_up 24
Ответы и объяснения 1
Число протонов=число электронов=порядковый номер(т.е. заряд элемента)
- 22.08.2017 12:55
- thumb_up 43
Знаете ответ? Поделитесь им!
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Строение атомов. Строение электронной оболочки атома
Вопрос 2 (2).
а) сравним строение атомов азота и фосфора.
Строение электронной оболочки этих атомов схоже, оба на последнем энергетическом уровне содержат по 5 электронов. Однако у азота всего 2 энергетических уровня, а у фосфора — 3.
б) Сравним строение атомов фосфора и серы.
Атомы фосфора и серы имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у фосфора на последнем энергетическом уровне 5 электронов, а у серы 6.
Вопрос 3 (3).
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3. Число внешних электронов определяется номером группы и равно 4.
Вопрос 4 (4).
Количество содержащихся в периоде элементов равно максимально возможному числу электронов на внешнем энергетическом уровне и это число определяется по формуле 2n 2 , где n — номер периода. Поэтому в первом периоде содержится только 2 элемента (2 . 1 2 = 2), а во втором периоде 8 элементов (2 . 2 2 = 8).
Вопрос 5 (5).
В астрономии — Период вращения Земли вокруг своей оси 24 часа.
В географии — Смена сезонов с периодом 1 год, а также морские приливы и отливы.
В физике — Периодические колебания маятника, движение поршня в двигателе внутреннего сгорания.
В биологии — Деление клеток микроорганизмов при оптимальных условиях через каждые 20 мин.
Вопрос 6 (6).
Электроны и строение атома были открыты в начале ХХ века, чуть позже было написано это стихотворение, которое отражает во многом нуклеарную, или планетарную, теорию строения атома, а также В. Брюсов допускает возможность, что и электроны тоже сложные частицы, строение которых учёные ещё не изучили.
Вопрос 7 (7).
Приведенные в учебнике выше поэтические строки говорят о большом поэтическом таланте В. Брюсова и гибком уме его, раз он мог так легко понять и принять все достижения современной ему науки. Эти два четверостишия показывают просвещенность и образованность поэта в данной области.
- Вы здесь:
- Главная

- Химия

- О.С. Габриелян-8кл

- Строение атомов | Параграф 8. (8)
Строение атомов. Строение электронной оболочки атома
Вопрос 2 (2).
а) сравним строение атомов азота и фосфора.
Строение электронной оболочки этих атомов схоже, оба на последнем энергетическом уровне содержат по 5 электронов. Однако у азота всего 2 энергетических уровня, а у фосфора — 3.
б) Сравним строение атомов фосфора и серы.
Атомы фосфора и серы имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у фосфора на последнем энергетическом уровне 5 электронов, а у серы 6.
Вопрос 3 (3).
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3. Число внешних электронов определяется номером группы и равно 4.
Вопрос 4 (4).
Количество содержащихся в периоде элементов равно максимально возможному числу электронов на внешнем энергетическом уровне и это число определяется по формуле 2n 2 , где n — номер периода. Поэтому в первом периоде содержится только 2 элемента (2 . 1 2 = 2), а во втором периоде 8 элементов (2 . 2 2 = 8).
Вопрос 5 (5).
В астрономии — Период вращения Земли вокруг своей оси 24 часа.
В географии — Смена сезонов с периодом 1 год, а также морские приливы и отливы.
В физике — Периодические колебания маятника, движение поршня в двигателе внутреннего сгорания.
В биологии — Деление клеток микроорганизмов при оптимальных условиях через каждые 20 мин.
Вопрос 6 (6).
Электроны и строение атома были открыты в начале ХХ века, чуть позже было написано это стихотворение, которое отражает во многом нуклеарную, или планетарную, теорию строения атома, а также В. Брюсов допускает возможность, что и электроны тоже сложные частицы, строение которых учёные ещё не изучили.
Вопрос 7 (7).
Приведенные в учебнике выше поэтические строки говорят о большом поэтическом таланте В. Брюсова и гибком уме его, раз он мог так легко понять и принять все достижения современной ему науки. Эти два четверостишия показывают просвещенность и образованность поэта в данной области.
- Вы здесь:
- Главная

- Химия

- О.С. Габриелян-8кл

- Строение атомов | Параграф 8. (8)
Электрон и электронная оболочка атома
Атом, который в целом является нейтральным, состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки (электронное облако), при этом, суммарные положительные и отрицательные заряды равны по абсолютной величине. При вычислении относительной атомной массы массу электронов не учитывают, так как она ничтожно мала и в 1840 раз меньше массы протона или нейтрона.
Электрон – совершенно уникальная частица, которая имеет двойственную природу: он имеет одновременно свойства волны и частицы. Они непрерывно движутся вокруг ядра.
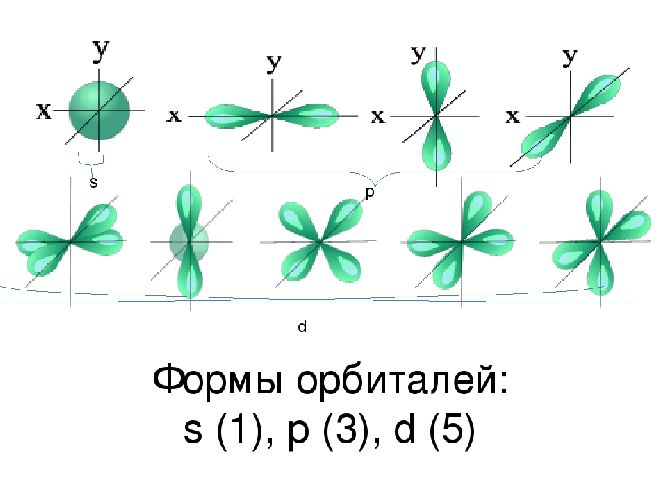
Пространство вокруг ядра, где вероятность нахождения электрона наиболее вероятна, называют электронной орбиталью, или электронным облаком. Это пространство имеет определенную форму, которая обозначается буквами s-, p-, d-, и f-. S-электронная орбиталь имеет шаровидную форму, p-орбиталь имеет форму гантели или объемной восьмерки, формы d- и f-орбиталей значительно сложнее.
Вокруг ядра электроны расположены на электронных слоях. Каждый слой характеризуется расстоянием от ядра и энергией, поэтому электронные слои часто называют электронными энергетическими уровнями. Чем ближе уровень к ядру, тем меньше энергия электронов в нем. Один элемент отличается от другого числом протонов в ядре атома и соответственно числом электронов. Следовательно, число электронов в электронной оболочке нейтрального атома равно числу протонов, содержащимся в ядре этого атома. Каждый следующий элемент имеет в ядре на один протон больше, а в электронной оболочке – на один электрон больше.
Вновь вступающий электрон занимает орбиталь с наименьшей энергией. Однако максимальное число электронов на уровне определяется формулой:
где N – максимальное число электронов, а n – номер энергетического уровня.
На первом уровне может быть только 2 электрона, на втором – 8 электронов, на третьем – 18 электронов, а на четвертом уровне – 32 электрона. На внешнем уровне атома не может находится больше 8 электронов: как только число электронов достигает 8, начинает заполняться следующий, более далекий от ядра уровень.
Строение электронных оболочек атомов
Каждый элемент стоит в определенном периоде. Период – это горизонтальная совокупность элементов, расположенных в порядке возрастания заряда ядер их атомов, которая начинается щелочным металлом, а заканчивается инертным газом. Первые три периода в таблице – малые, а следующие, начиная с четвертого периода – большие, состоят из двух рядов. Номер периода, в котором находится элемент имеет физический смысл. Он означает, сколько электронных энергетических уровней имеется в атоме любого элемента данного периода. Так, элемент хлор Cl находится в 3 периоде, то есть его электронная оболочка имеет три электронных слоя. Хлор стоит в VII группе таблицы, причем в главной подгруппе. Главной подгруппой называется столбец внутри каждой группы, который начинается с 1 или 2 периода.
Таким образом, состояние электронных оболочек атома хлора таково: порядковый номер элемента хлора – 17, что означает, что атом имеет в ядре 17 протонов, а в электронной оболочке – 17 электронов. На 1 уровне может быть только 2 электрона, на 3 уровне – 7 электронов, так как хлор находится в главной подруппе VII группы. Тогда на 2 уровне находится:17-2-7=8 электронов.