Ядро атома. Ещё раз о причине периодичности и природе заряда.
Кое-что о природе заряда ядра говорит известный закон английского учёного Генри Мозли (1913 г.). Закон Мозли прост: частота характеристического рентгеновского излучения химического элемента есть линейная функция его порядкового номера (Z). Порядковый номер элемента соответствует заряду ядра элемента, иначе, количеству протонов в ядре атома элемента. Однако в ядре атома есть не только протоны, но и нейтроны, частицы без заряда. Количество протонов и нейтронов в ядре примерно равно. Так что заряд ядра равен половине массы ядра. В рентгеновском аппарате на видео происходит вот что. Ускоренные электроны в поле электрического потенциала в 35 тысяч вольт бьют с большой силой в антикатод, сделанный из трёх разных элементов: железа, меди и молибдена (по очереди). Возникает тормозное рентгеновское излучение сплошного спектра. При большой энергии электронов возникает не только сплошной спектр рентгеновского излучения, но и характеристическое излучение в виде пиков, максимумов. Но, чтобы увидеть такую картинку, излучение должно пройти через дифракционную решетку кристалла, который поворачивается на угол в 30 градусов. Волны излучения огибают узлы решетки кристалла под разными углами, образуя общую картину спектра. Для каждых атомов химических элементов пики на шкале частот излучения свои, единственные. Чем тяжелее ядро атома – тем короче длина излучаемых волн, больше их энергия.
Принято считать, что энергичные электроны выбивают электроны у атомов элементов антикатода, выбивают из ближних к ядру электронных оболочек К и L. Опустевшее место занимают электроны с верхних оболочек, испуская рентгеновские фотоны. На самом деле картина не так проста и понятна. Сомнение вызывает само существование электронных оболочек вокруг ядра атома. Дело в том, что и само ядро атома имеет оболочечную структуру. Частицы ядра тоже располагаются в определённой последовательности, своим порядком. Никакого хаоса в движении ядерных частиц нет. Получается так, что природа продублировала структуру ядер и структуру электронных оболочек, пусть не совсем в точности, но всё же. Прежний опыт нам говорит, что на дублирование такого рода природа скупа, и вряд ли будет здесь повторяться. В действительности мы имеем дело только с ядрами и волновыми полями вокруг ядер. Вся масса атома сосредоточена в ядре (99,9%), и сомнительно, чтобы лёгкие электроны отвечали за все физические и химические особенности атомов. В формуле закона Мозли, совсем без ущерба для главной идеи, можно величину Z заменить величиной массы ядра. И тогда характеристическая частота рентгеновского излучения будет линейной функцией массы элемента (массы ядра). Это даже ближе к мысли Д. И. Менделеева, ведь изначально он строил свою Периодическую систему элементов по возрастанию атомных масс (весов). И формула Мозли будет выглядеть более соответственно: частота характеристического рентгеновского излучения (энергия фотона) пропорциональна массе (полной энергии) ядра.
Протоны, электроны, заряд ядра
Закон Мозли говорит о линейности, о строгой последовательности появления характеристических рентгеновских частот. Никакой периодической зависимости, периодической изменчивости тут не наблюдается. Получается так, что заряд ядра вовсе не связан с явлением периодичности, с периодической повторяемостью свойств элементов. С периодичностью связана другая особенность ядра – особенность структуры, строение ядра и характер движения частиц ядра. Периодически изменяется (с последовательным прибавлением частиц) характер их движения, и периодически изменяются физические и химические свойства элементов. Свойства элементов связаны с устойчивостью, с симметричностью или асимметричностью динамических комбинаций ядерных частиц (нуклонов). А уж устойчивость, симметричность и асимметричность системы определяются периодическим характером движения самих частиц и периодическим механизмом их связи. Закон Мозли лишь чётко указывает на прямой рост энергии ядер с ростом их массы. Чем массивнее, тяжелее ядра, тем с большими энергиями движутся их частицы, с большей частотой вращаются в своих ядерных оболочках.
Извините, коли речь зашла о природе атомного ядра и причине периодичности, то мне надо вспомнить мою давнюю научную идею, изображаемую спиральным вариантом Периодической системы химических элементов Менделеева. Не буду теорию излагать здесь целиком, лишь отмечу главный принцип. А именно, решающее значение в ядерной связи частиц, в динамической устойчивости частиц в ядерной оболочке имеет их значение угловых моментов в Пи радианах. Все устойчивые ядерные оболочки имеют в сумме угловой момент (момент вращения), кратный 2Пи, иначе, принцип целочисленности волн де Бройля. Нарушение целочисленности, симметричности структуры ядерной оболочки ведёт к появлению у атома тех или иных свойств, к появлению способности вступать в связь с другими элементами. Интересен механизм того, как атом одного элемента вступает в крепкую связь с атомом или атомами других элементов, где тут «зацепки», «крючки»… Сегодня связь между атомами объясняют взаимодействием статических электрических зарядов. Связь делят на ионную, ковалентную, металлическую. Атомы либо отдают свой отрицательный заряд, либо получают, либо обобществляют, лишь бы в итоге иметь устойчивую конфигурацию внешней оболочки благородных газов с минимумом энергии. Вникать в проблему природы этого самого электрического заряда никому не хочется, заряды есть – и ладно! С этим «мусором под ковром» мы пережили весь двадцатый век и с ним же вошли в двадцать первый. Хотя всем разумным людям понятно, что никакого статического поля электрического заряда нет. Поля есть, но они представляют собой поля беспрерывного кручения, вращения. Левый винт кручения, условно говоря, соответствует заряду плюс, правый винт – минус. Отвечает за появление этих самых зарядов круговое вращение протона. Протон, являясь симметричным радиальным колебанием среды вакуума (дыхание вакуума), способен, как целое, двигаться поступательно и вращательно, образуя тор, кольцо. Вот это кольцо и есть диполь, магнетон, основа всякого атома, ядра атома.
С какой бы скоростью в заполненной ядерной оболочке ни вращался протон в круговом движении, и с каким бы радиусом, но его угловой момент вращения в любой момент времени будет всегда кратен 1/4 Пи радиан. В сумме все вращающиеся протоны в устойчивой заполненной ядерной оболочке дают величину углового момента 2Пи. В Периодической системе (спиральный вариант) у элементов первой, второй и третьей группы в движении ядерных частиц наблюдается асинхронность, что тождественно здесь со смещённой синхронностью. Причина – опережение фазы углового момента на величину, кратную 1/4 Пи. Дополнительные прибавляющиеся частицы вносят в согласованное движение частиц ядерной оболочки смещение фазы углового момента. У элементов первой группы – на 1/4 Пи, у элементов второй группы – на 1/2 Пи, у элементов третьей группы – на 3/4 Пи. Четвертая группа системы элементов – водораздел, отделяющая так называемые электроположительные элементы от электроотрицательных элементов. Элементы четвёртой группы углерода (Пи) могут быть и электроположительными, и электроотрицательными. Элементы пятой (5/4 Пи), шестой (3/2 Пи) и седьмой (7/4 Пи) группы системы являются электроотрицательными, потому что охотно прибирают себе электроны элементов первых трёх групп. В движении частиц ядер элементов 5, 6 и 7 групп системы происходит запаздывание фазы углового момента, что тоже вызывает асинхронность общего движения ядерных частиц. Асинхронность с обратным знаком. Как видите, электроположительность и электроотрицательность объясняются здесь лишь смещением фазы углов орбитальных моментов вращающихся протонов. Соединение «электроотрицательных» элементов с «электроположительными» обусловлено явлением синхронизации. Асинхронность движения ядерных частиц элемента с опережающей фазой углового момента соединяется с асинхронностью элемента с запаздывающей фазой углового момента и получается синхронность, согласование, гармония в общем движении частиц, целочисленность Пи радиан. Пример: молекула поваренной соли, связь атома натрия с атомом хлора. Ядро атома натрия – опережающая асинхронность фазы 1/4 Пи. Ядро атома хлора – запаздывающая асинхронность фазы 7/4 Пи. В сумме две асинхронности дают синхронность 2Пи. Другой пример, более сложный, где связь образуют как бы два элемента запаздывающей фазы – молекула воды: атом кислорода (6/4 Пи) и два атома водорода (7/4 Пи). Дело в том, что водород ярко проявляет двойственные свойства: и щелочных металлов (1 группа), и галогенов (7 группа). Ядро атома кислорода – запаздывающая асинхронность фазы 6/4 Пи. Два ядра атома водорода – в сумме запаздывающая асинхронность фазы 14/4 Пи. В итоге – 5 Пи. Когда же водород идёт опережающей асинхронностью фазы первой группы, то итог суммы – 2 Пи. То есть, несмотря на простоту трактовки – тут не всё так просто и однозначно. Позвольте на этом остановиться. Гипотеза очерчена достаточно.
Вот так, с Божьей помощью, мы сможем со временем преодолеть зарядовый мистицизм. Ведь надо, наконец, выметать сор из-под ковра и наводить тут элементарный порядок. Ведь стыдно, на дворе – двадцать первый век, а мы до сих пор используем представления и образы восемнадцатого века! Ломоносов не побоялся изгнать теплород из научного обихода. А нам-то что мешает изгнать давно устаревшее представление об электрическом заряде?! Да, привыкли, удобно, просто, без затей… Плюс и минус – притягиваются; Плюс и плюс – отталкиваются. Красота! Мир частиц, атомов – это мир колебаний и периодических движений. Так и надо искать такие особенности периодических движений, которые наглядно и непротиворечиво давали бы нам понимание законов этого мира, в том числе – природу заряда.
P.S. У меня есть давняя, очень давняя мечта — сделать средствами мультипликации картинку взаимодействия атомов наглядной, живой. Как атомы с различной динамической асимметрией вступают во взаимодействие и как эти асимметрии в молекуле становятся динамической симметрией.
Состав атомного ядра. Число протонов
Предложенная Э. Резерфордом в (1911) году ядерная (планетарная) модель строения атома сводится к следующим положениям:
- атом состоит из положительно заряженного ядра и движущихся вокруг него электронов;
- более (99,96) % массы атома сосредоточено в его ядре;
- диаметр ядра примерно в сто тысяч раз меньше диаметра самого атома.
Согласно этой модели можно дать следующее определение атома:
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Ядро атома состоит из элементарных частиц: протонов и нейтронов . Протоны и нейтроны имеют общее название нуклоны (ядерные частицы).
Протон ((p)) — частица, имеющая заряд (+1) и относительную массу, равную (1).
Нейтрон ((n)) — частица без заряда с относительной массой (1).
К элементарным частицам относятся также электроны ( е _ ), которые образуют электронную оболочку атома.
Рис. (1). Строение атома
Протоны и нейтроны имеют одинаковую массу. Масса электрона составляет 1 1840 массы протона и нейтрона. Поэтому основная масса атома сосредоточена в его ядре.
Протон имеет положительный заряд (+1). Заряд электрона — отрицательный и по величине равен заряду протона: (–)(1).
Структура ядра
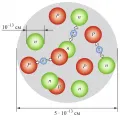
Рис. 4. Схематическое изображение ядра углерода-12, состоящего из 6 протонов и 6 нейтронов, взаимодействующих посредством обмена мезонами. Иллюстрация: БРЭ. Рис. 4. Схематическое изображение ядра углерода-12, состоящего из 6 протонов и 6 нейтронов, взаимодействующих посредством обмена мезонами. Иллюстрация: БРЭ. Расстояния в ядерной физике принято измерять в ферми (Фм; 1 Фм = 10 –15 м, т. е. совпадает по величине с фемтометром). Атомное ядро представляет собой систему плотно упакованных нуклонов, среднее расстояние между которыми (1,5–2,0 Фм) сравнимо с размером нуклона. Нуклоны в ядре удерживаются мощными и короткодействующими ядерными силами притяжения, возникающими вследствие сильного взаимодействия между кварками и глюонами , из которых состоят нуклоны. Нуклон-нуклонное взаимодействие внутри атомного ядра реализуется путём обмена мезонами , прежде всего π-мезонами (рис. 4), которые, как и нуклоны, являются адронами , т. е. состоят из кварков и глюонов. Последовательное описание такого взаимодействия возможно лишь в рамках квантовой хромодинамики . Решение этой важнейшей проблемы ядерной физики до сих пор актуально.
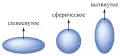
Рис. 5. Возможные формы ядер. Архив БРЭ. Рис. 5. Возможные формы ядер. Архив БРЭ. Форма атомных ядер может быть различной. Но в любом случае это системы с центром симметрии . Есть ядра, имеющие сферическую форму. Большинство же ядер имеют форму, слегка отличающуюся от сферической. Несферические ядра (их также называют деформированными ядрами ) имеют форму, близкую к аксиально симметричному эллипсоиду, сплюснутому или вытянутому (рис. 5).

Рис. 6. Зависимость плотности заряда различных ядер от расстояния до центра ядра. Архив БРЭ. Рис. 6. Зависимость плотности заряда различных ядер от расстояния до центра ядра. Архив БРЭ. Для ядер с A ≥ 20 A ≥ 20 A ≥ 20 средняя плотность нуклонов меняется мало, т. е. объём ядра пропорционален A , A, A , а его радиус R R R пропорционален A ⅓ , text A^, A ⅓ , т. е. R = r 0 A . R = r_0A. R = r 0 A . Константа r 0 r_0 r 0 лежит в пределах 1,0–1,2 Фм. Плотность заряда и вещества максимальна в центре ядра и спадает к его границе (рис. 6), причём толщина поверхностного слоя, характеризующая этот спад, практически одинакова у различных ядер и составляет около 2,4 Фм. Средняя плотность ядерного вещества – около 10 17 кг/м 3 .
Энергия связи ядра
Энергетической характеристикой атомного ядра является его энергия связи – минимальная энергия, которая необходима для расщепления ядра на свободные нуклоны:
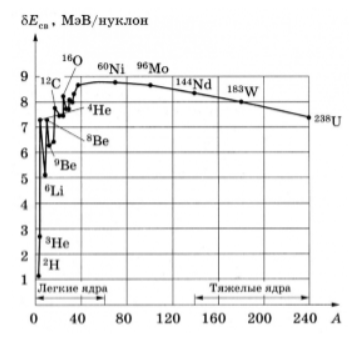
E св = ( Z m p + N m n ) c 2 – M c 2 , E_ = (Zm_p + Nm_n)c^2 – Mc^2, E св = ( Z m p + N m n ) c 2 – M c 2 , где M , M, M , m p , m_p, m p , m n m_n m n – масса ядра, протона и нейтрона соответственно, c c c – скорость света. E св E_ E св ядра тем больше, чем больше A , A, A , а удельная энергия связи (энергия связи, приходящаяся на 1 нуклон) для большинства ядер лежит в интервале энергий 7–9 МэВ (рис. 7). Такая особенность удельной энергии связи атомного ядра объясняется короткодействием ядерных сил: нуклон в ядре, как правило, взаимодействует лишь со своим ближайшим окружением.
Постоянство плотности и удельной энергии связи позволяет рассматривать атомное ядро как каплю заряженной жидкости, что привело к разработке капельной модели ядра . На основе этой модели немецкий физик К. Ф. фон Вайцзеккер в 1935 г. предложил полуэмпирическую формулу для энергии связи ядра, названную формулой Вайцзеккера :
E св = a 1 A – a 2 A 2 / 3 – a 3 Z ( Z – 1 ) A – 1 / 3 – a 4 ( N – Z ) 2 A – 1 + a 5 A – 3 / 4 , E_ = a_1A – a_2A^ – a_3Z(Z–1)A^ – a_4(N–Z)^2A^ + a_5A^, E св = a 1 A – a 2 A 2/3 – a 3 Z ( Z –1 ) A –1/3 – a 4 ( N – Z ) 2 A –1 + a 5 A –3/4 , где a 1 , a_1, a 1 , a 2 , a_2, a 2 , a 3 , a_3, a 3 , a 4 , a_4, a 4 , a 5 a_5 a 5 – эмпирические коэффициенты, имеющие размерность энергии.
В дальнейшем были обнаружены ядра, у которых наблюдались значительные отклонения от формулы Вайцзеккера. Это магические ядра , проявляющие наибольшую устойчивость, т. е. имеющие аномально большую энергию связи по сравнению с близкими по составу нуклидами и повышенную распространённость в природе. Их форма близка к сферической, а число нейтронов и/или протонов в них равно 2, 8, 20, 28, 50, 82 и 126. Обнаружение и исследование магических ядер привело к созданию оболочечной модели ядра .

Рис. 7. Зависимость удельной энергии связи атомного ядра от массового числа. Архив БРЭ. Рис. 7. Зависимость удельной энергии связи атомного ядра от массового числа. Архив БРЭ. Атомное ядро – потенциальный источник огромной энергии. Зависимость удельной энергии связи от числа нуклонов (рис. 7) имеет максимум при A ≈ Aapprox A ≈ 50–60, где располагаются наиболее устойчивые ядра. Поэтому существуют два возможных процесса, позволяющих извлечь ядерную энергию : деление тяжёлых ядер и синтез (слияние) лёгких ядер. В обоих процессах удельная энергия связи конечных ядер возрастает и возникающий при этом избыток энергии освобождается. Первый процесс, проходящий при возникновении неуправляемой цепной ядерной реакции деления, может привести к ядерному взрыву , а идущий в контролируемом режиме используется в ядерных реакторах . Второй процесс ( термоядерные реакции ) имеет место в звёздах и был реализован человечеством в термоядерном оружии (водородной бомбе). Предпринимаются попытки создания термоядерного реактора для использования этой самой большой (при расчёте на единицу массы топлива) энергии в мирных целях.
Проскок электрона
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d 9 4s 2 . Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d 10 4s 11

| Итог: иметь конфигурации nd 5 и nd 10 более энергетически выгодно, чем nd 4 и nd 9 . Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний. |
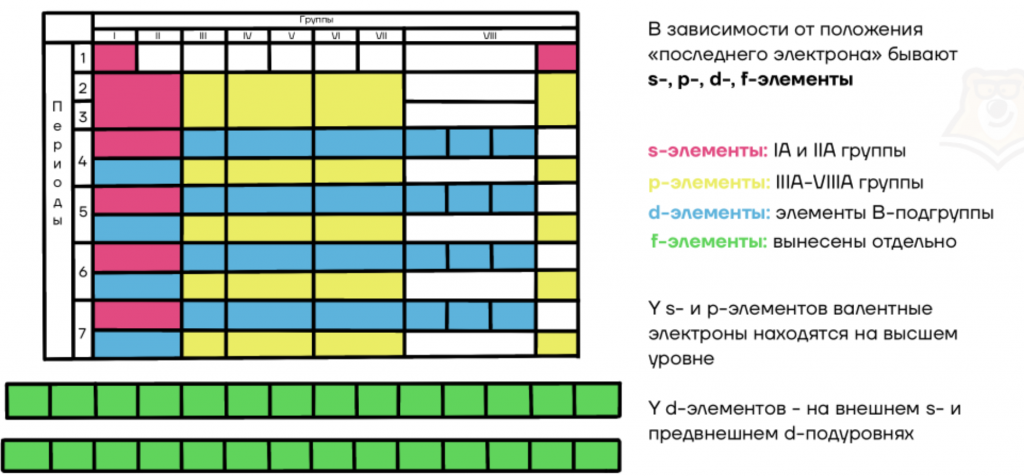
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.
У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.
Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек
- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.
Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
Характеристики ядра
Основными характеристиками атомных ядер являются электрический заряд, масса, спин, энергия связи и так далее.
Ядро каждого из атомов обладает положительным зарядом. В качестве носителя положительного заряда выступает протон. По той причине, что заряд протона численно эквивалентен заряду электрона e , можно записать, что заряд ядра элемента равен + Z e ( Z выражает собой целое число, которое указывает на порядковый номер химического элемента в периодической системе химических элементов Д. И. Менделеева). Значение Z также характеризует число протонов, входящих в состав ядра и количество электронов в атоме. Именно из-за этого его определяют как атомный номер ядра. Электрический заряд представляет собой одну из основных характеристик атомного ядра, от которой зависят оптические, химические и иные свойства атомов.
Масса ядра
Существует также другая значимая характеристика ядра, а именно масса. Массу атомов и ядер принято выражать в атомных единицах массы (а.е.м.), в качестве атомной единицы массы выступает 1 12 массы нуклида углерода C 6 12 :
где N A = 6 , 022 · 10 23 м о л ь — 1 обозначает число Авогадро.
Кроме того, есть другой способ выражения атомной массы: исходя из соотношения Эйнштейна E = m c 2 , ее выражают в единицах энергии. По той причине, что масса протона m p = 1 . 00728 а . е . м . = 938 , 28 М э В , масса нейтрона m n = 1 . 00866 а . е . м . = 939 , 57 М э В , а масса электрона m e = 5 , 49 ⋅ 10 — 4 а . е . м . = 0 , 511 М э В ,
Из приведенных выше значений видно, что масса электрона несущественно мала, если сравнивать ее с массой ядра, поэтому масса ядра практически эквивалентна массе всего атома и отлична от целых чисел.
Атомы
Атом — это мельчайшая химически неделимая частица вещества, а также наименьшая часть химического элемента, являющаяся носителем его свойств. Химически неделимая означает, что атом в ходе химических реакций не делится на более мелкие части.
Атомы очень маленькие частицы, их размер находится в диапазоне от одного до пяти ангстрем (обозначается — Å.). Один ангстрем — это 10 –10 метра.
Состав и строение атомов
Атомы состоят из ещё более мелких частиц.
В центре любого атома находится положительно заряженное ядро. В пространстве вокруг ядра находятся отрицательно заряженные частицы — электроны, которые образуют так называемое электронное облако . Таким образом, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Пример. Атом гелия состоит из ядра, в котором находятся два протона и два нейтрона, и двух электронов:

Ядро атома — это центральная часть атома, в которой сосредоточена основная его масса и весь положительный электрический заряд. Ядро атома состоит из протонов и нейтронов.
Протон — это частица, которая имеет положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона — p + .
Нейтрон — это частица, не имеющая электрического заряда. Заряд нейтрона равен 0. Символ нейтрона — n 0 .
Протоны и нейтроны имеют общее название — нуклоны.
Ядра атомов имеют положительный заряд, так как состоят из протонов с положительным зарядом и нейтронов. По величине заряд равен количеству протонов в ядре и совпадает с порядковым номером элемента в периодической системе.
Электрон — это частица, которая имеет отрицательный электрический заряд. Заряд электрона в условных единицах равен -1. Символ электрона — e .
Протоны, нейтроны и электроны имеют общее название — элементарные частицы или субатомные частицы.
| Протон | p + | +1 |
| Нейтрон | n 0 | 0 |
| Электрон | e | -1 |
Заряд протона и электрона одинаковы по величине, но противоположны по знаку. Любой атом содержит равное число протонов и электронов, значит заряд ядра и суммарный заряд всех электронов атома одинаковы по величине, но противоположны по знаку. Следовательно, атомы являются электронейтральными частицами.
Электроны
Электроны – это элементарные частицы, которые обращаются вокруг ядра атома. Они имеют отрицательный электрический заряд и очень малую массу по сравнению с протонами и нейтронами.
Электроны находятся в разных энергетических уровнях, которые называются электронными оболочками. Каждая оболочка может содержать определенное количество электронов. Первая оболочка может содержать до 2 электронов, вторая – до 8 электронов, третья – до 18 электронов и так далее.
Электроны внешней оболочки, называемой валентной оболочкой, играют важную роль в химических реакциях. Они могут образовывать связи с электронами других атомов, образуя молекулы. Количество электронов в валентной оболочке определяет химические свойства атома и его способность образовывать связи с другими атомами.
Электроны также могут поглощать или испускать энергию в виде фотонов, что приводит к электромагнитному излучению, такому как свет или радиоволны.
Заряд ядра
Ядро атома состоит из протонов и нейтронов. Протоны имеют положительный электрический заряд, а нейтроны не имеют заряда и являются нейтральными частицами.
Заряд ядра определяется количеством протонов в нем. Каждый протон имеет заряд +1 единица элементарного заряда. Нейтроны не влияют на заряд ядра, так как они не имеют заряда.
Заряд ядра определяет химические свойства атома. Атомы с разными зарядами ядра называются ионами. Если атом имеет больше протонов, чем электронов, он будет иметь положительный заряд и называться положительным ионом. Если атом имеет меньше протонов, чем электронов, он будет иметь отрицательный заряд и называться отрицательным ионом.
Заряд ядра также влияет на взаимодействие атомов между собой. Атомы с противоположными зарядами притягиваются друг к другу, образуя химические связи. Это обуславливает возможность образования молекул и соединений.
Атомы
Атом — это мельчайшая химически неделимая частица вещества, а также наименьшая часть химического элемента, являющаяся носителем его свойств. Химически неделимая означает, что атом в ходе химических реакций не делится на более мелкие части.
Атомы очень маленькие частицы, их размер находится в диапазоне от одного до пяти ангстрем (обозначается — Å.). Один ангстрем — это 10 –10 метра.
Состав и строение атомов
Атомы состоят из ещё более мелких частиц.
В центре любого атома находится положительно заряженное ядро. В пространстве вокруг ядра находятся отрицательно заряженные частицы — электроны, которые образуют так называемое электронное облако . Таким образом, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Пример. Атом гелия состоит из ядра, в котором находятся два протона и два нейтрона, и двух электронов:

Ядро атома — это центральная часть атома, в которой сосредоточена основная его масса и весь положительный электрический заряд. Ядро атома состоит из протонов и нейтронов.
Протон — это частица, которая имеет положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона — p + .
Нейтрон — это частица, не имеющая электрического заряда. Заряд нейтрона равен 0. Символ нейтрона — n 0 .
Протоны и нейтроны имеют общее название — нуклоны.
Ядра атомов имеют положительный заряд, так как состоят из протонов с положительным зарядом и нейтронов. По величине заряд равен количеству протонов в ядре и совпадает с порядковым номером элемента в периодической системе.
Электрон — это частица, которая имеет отрицательный электрический заряд. Заряд электрона в условных единицах равен -1. Символ электрона — e .
Протоны, нейтроны и электроны имеют общее название — элементарные частицы или субатомные частицы.
| Протон | p + | +1 |
| Нейтрон | n 0 | 0 |
| Электрон | e | -1 |
Заряд протона и электрона одинаковы по величине, но противоположны по знаку. Любой атом содержит равное число протонов и электронов, значит заряд ядра и суммарный заряд всех электронов атома одинаковы по величине, но противоположны по знаку. Следовательно, атомы являются электронейтральными частицами.