Текст является частью пособия по химии.
Автор текста – Анисимова Елена Сергеевна. https://vk.com/bch_5
Авторские права защищены. При копировании и передаче текста указание автора и ссылка на ВК обязательны.
Распространение и изучение текста приветствуется. – Давайте станем более информированными.
Курсивом набран текст пояснений, напоминаний или фактов на будущее. При первом чтении или спешке его можно не читать.
Справа расположены рекомендации.
Параграф 1: Элементарные частицы
Параграф 2: Атом
Параграф 3: Ионы
Параграф 1: Элементарные частицы
В природе есть вещицы, которые называют:
протонами, электронами и нейтронами.
Эти частицы относятся к элементарным частицам.
Эти три – основные, но есть и множество других.
Элементарные частицы очень маленькие по размерам, он не видны в микроскопы.
Масса элементарных частиц
Кратко: масса протона и нейтрона – по 1, масса электрона почти ноль.
Масса протона равна условной единице.
(См. определение атомной единицы массы).
Масса нейтрона почти равна массе протона, то есть тоже единице.
Масса электрона не ноль, но в 1836 раз меньше протона, и часто не учитывается.
Оформим эти сведения в виде маленькой таблицы для упрощения усвоения:
Протон Нейтрон Электрон
Масса 1 1 Почти 0
Заряды элементарных частиц (электрические заряды)
Кратко: заряд нейтрона – ноль, протона – плюс 1, электрона – минус 1.
Что такое электрический заряд?
Существует такое свойство тел, которое называют электрическим зарядом.
Наличие электрического заряда проявляется в способности реагировать на другие предметы, имеющие электрический заряд.
Реакция (заряженного тела на заряд другого) проявляется в том, что предмет, имеющий электрический заряд,
— или притягивается к другому заряженному предмету,
— или отталкивается от него.
Типы эл. зарядов.
Заряд бывает двух типов – один тип эл. заряда назван положительным, а другой тип – отрицательным.
Принято говорить, что положительный и отрицательный – разноимённые.
Положительный заряд притягивается к отрицательному (то есть разноимённые заряды притягиваются). Точнее, тела с такими зарядами.
Положительный от положительного отталкивается, отрицательный от отрицательного тоже отталкивается.
(То есть одноимённые отталкиваются – точнее, тела с одноимёнными зарядами).
Заряд нейтрона
У нейтрона нет электрического заряда, то есть он электронейтрален (отсюда и его название – нейтрон). То есть нейтрон не реагирует на частицы с эл. зарядом.
Заряды протона и нейтрона
У протона и электрона есть электрические заряды –
равные по величине, но противоположные по «знаку». –
Заряд протона считается положительным,
а заряд электрона считается отрицательным.
Величина заряда
Величина заряда протона или электрона принята за условную единицу.
Строение атома. Как составить электронную и электронно-графическую формулы?
Суммарный заряд протона и электрона равен нулю. (Сумма электро-нейтральна).
(Плюс один и минус один в сумме дают ноль.)
Когда число протонов равно числу электронов, то суммарный заряд равен нулю.
Если число протонов больше или меньше числа электронов – заряд не нулевой.
Таблицы «Заряды элементарных частиц»:
Протон Электрон Нейтрон
Заряд Плюс 1 Минус 1 0
Обобщение по свойствам элементарных частиц.
Таким образом, у нейтрона нет заряда, а у электрона почти нет массы.
Массы протона и нейтрона – по единице.
Заряды протона и электрона – по единице.
Свойства протона: масса 1 и заряд +1.
Свойства нейтрона: масса 1 и заряд 0.
Свойства электрона: масса 0 и заряд –1.
Обобщим сведения об основных свойствах элементарных частиц в таблице:
«Свойства элементарных частиц»
Протон Электрон Нейтрон
Масса 1 0 1
Заряд Плюс 1 Минус 1 Ноль
(нет заряда)
Это очень простые сведения.
Но из них есть множество важных выводов.
Из них выводится множество фактов. Так что эту таблицу – знать.
Элементарные частицы в природе
Потоки протонов и электронов распространяются от Солнца по всей Солнечной системе!
В каком виде существуют элементарные частицы в природе?
В «свободном виде» протоны и электроны есть в Солнце и многих других звёздах.
От Солнца протоны и электроны распространяются прочь от Солнца – по Солнечной системе. Этот поток заряженных частиц называют солнечным ветром.
Солнечный ветер оказывает влияние на жизнь людей:
он может приводить к сбоям техники, электроники, связи!
А если бы не атмосфера (воздушная оболочка Земли), то солнечный ветер мог бы погубить живые организмы Земли!
Но на Земле протоны, электроны и нейтроны обычно объединяются,
образуя системы: а-то-мы. (См. также ионы).
В космосе атомы тоже есть – в молекулярных облаках между звёздами.
Параграф 2: Атом
Протоны, электроны и нейтроны существуют в природе обычно не по отдельности,
а объединяются в единые системы.
Часто система из элементарных частиц содержит одинаковое число протонов и электронов.
Такая система из равного числа протонов и электронов называется атомом.
Атом тоже считается частицей, но уже не элементарной.
Атом – ключевое понятие в науках о веществах.
Часто в атоме есть и нейтроны. –
Иногда нейтронов в атоме столько же, сколько и протонов, иногда меньше (у протия), а иногда нейтронов намного больше, чем протонов; чем больше в атоме протонов – тем больше и нейтронов на долю протонов.
Протоны и электроны могут входить в состав единой системы,
которая называется атомом.
(Если протонов и электронов поровну).
Как уже сказано, число протонов и электронов в атоме всегда равное.
Из-за этого суммарный заряд протонов (он равен числу протонов со знаком плюс)
и суммарный заряд электронов (он равен числу электронов со знаком минус)
в сумме дают ноль – нейтральный заряд атома как целого или просто отсутствие заряда у атома.
Параграф 3: И-о-ны
Некоторые атомы могут присоединять к себе «лишние» электроны.
Некоторые атомы могут терять свои электроны (обычно от 1 до 7).
После потери электрона или присоединения электронов заряд атома перестаёт быть нулевым, и атом уже не атом!
Если атом теряет электрон или присоединяет к себе электрон, то он:
перестаёт быть нейтральным, перестаёт считаться атомом,
и получает название ИОН.
Ион не является нейтральной частицей.
Ион всегда имеет заряд, в отличие от атома.
Ион – это бывший атом; зарядившийся атом.
Атом плюс или минус электрон(ы) = ион
Но. Зарядившиеся молекулы тоже называют ионами – см. далее!
Какие бывают ионы…
Если атом теряет электроны (а вместе с ними и отрицательные заряды),
то в возникшем ионе:
имеется дефицит отрицательных зарядов (по сравнению с бывшим атомом),
что даёт иону положительный заряд.
Кратко: потеря электронов атомом превращает его в положительный ион (катион).
Атом минус электрон(ы) = ион с положительным зарядом (катион)
Если атом присоединяет к себе электроны (и отрицательный заряд вместе с ними),
то в возникшем ионе имеется избыток отрицательных зарядов.
Кратко: приобретение электронов атомом превращает его в отрицательный ион (анион).
Атом плюс электрон(ы) = ион с отрицательным зарядом (анион)
Явление превращения атома в ион (в результате присоединения электрона или потери электрона) называется ионизацией.
Где встречаются ионы
Ионы есть везде – на Земле, в воле, почве, воздухе, организме.
В Солнце в основном ионы, а атомов мало или нет, то есть вещество в ионизированном состоянии.
Типы атомов
Сколько бывает протонов в атомах?
Об этом – в файле «Типы атомов. Химические элементы».
Массы трех фундаментальных частиц, выраженные в а.е.м., имеют следующие значения:
масса протона – 1.007277 а.е.м., масса нейтрона – 1.008665 а.е.м., масса электрона – 0.000548 а.е.м.
Указывать массу электрона 0- принципиальная ошибка,вводит учеников в дальнейшие заблуждения.
Частица, имеющая большее; число протонов, чем электронов: 1 – атом магния; 2 – атом фтора; 3 – ион фтора;
Обучайтесь и развивайтесь всесторонне вместе с нами, делитесь знаниями и накопленным опытом, расширяйте границы знаний и ваших умений.
поделиться знаниями или
запомнить страничку
- Все категории
- экономические 43,679
- гуманитарные 33,657
- юридические 17,917
- школьный раздел 612,672
- разное 16,911
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Состав атомного ядра. Число протонов
Предложенная Э. Резерфордом в (1911) году ядерная (планетарная) модель строения атома сводится к следующим положениям:
- атом состоит из положительно заряженного ядра и движущихся вокруг него электронов;
- более (99,96) % массы атома сосредоточено в его ядре;
- диаметр ядра примерно в сто тысяч раз меньше диаметра самого атома.
Согласно этой модели можно дать следующее определение атома:
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Ядро атома состоит из элементарных частиц: протонов и нейтронов . Протоны и нейтроны имеют общее название нуклоны (ядерные частицы).
Протон ((p)) — частица, имеющая заряд (+1) и относительную массу, равную (1).
Нейтрон ((n)) — частица без заряда с относительной массой (1).
К элементарным частицам относятся также электроны ( е _ ), которые образуют электронную оболочку атома.
Рис. (1). Строение атома
Протоны и нейтроны имеют одинаковую массу. Масса электрона составляет 1 1840 массы протона и нейтрона. Поэтому основная масса атома сосредоточена в его ядре.
Протон имеет положительный заряд (+1). Заряд электрона — отрицательный и по величине равен заряду протона: (–)(1).
Классификация
Ионы делятся на две группы:
- простые или моноатомные – содержат одно ядро, т.е. состоят из одного атома вещества;
- сложные или полиатомные – содержат минимум два ядра, т.е. состоят из двух и более атомов вещества.
К простым ионам относятся катионы и анионы металлов и неметаллов – Na + , Mg 2+ , Cl – . Сложные ионы образуются при присоединении иона к нейтральным молекулам вещества. Например:
Катионами являются ионы металлов, водорода, аммония и некоторых других веществ. Анионами являются гидроксид-ион (OH – ), ионы кислотных остатков, неметаллов и других веществ.
Некоторые атомы могут становиться катионами или анионами в зависимости от реакции.
Также выделяют ион-радикалы – свободные заряженные частицы, способные присоединять атомы или присоединяться к атомам других веществ. В зависимости от заряда делятся на китионы-радикалы и анионы-радикалы.
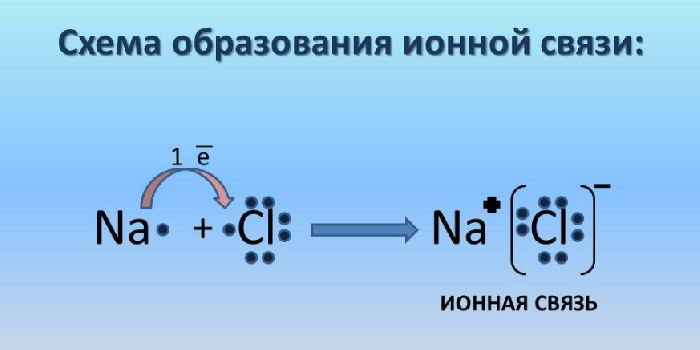
Ионная связь – класс соединения ионов. Ионная связь возникает в результате электростатического притяжения анионов и катионов. При этом атом с большей электроотрицательностью притягивает атом с меньшей электроотрицательностью. Ионная связь возникает преимущественно между ионами металлов и неметаллов. Металл всегда отдаёт электроны, т.е. является восстановителем.
Атомы
Атом — это мельчайшая химически неделимая частица вещества, а также наименьшая часть химического элемента, являющаяся носителем его свойств. Химически неделимая означает, что атом в ходе химических реакций не делится на более мелкие части.
Атомы очень маленькие частицы, их размер находится в диапазоне от одного до пяти ангстрем (обозначается — Å.). Один ангстрем — это 10 –10 метра.
Состав и строение атомов
Атомы состоят из ещё более мелких частиц.
В центре любого атома находится положительно заряженное ядро. В пространстве вокруг ядра находятся отрицательно заряженные частицы — электроны, которые образуют так называемое электронное облако . Таким образом, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Пример. Атом гелия состоит из ядра, в котором находятся два протона и два нейтрона, и двух электронов:

Ядро атома — это центральная часть атома, в которой сосредоточена основная его масса и весь положительный электрический заряд. Ядро атома состоит из протонов и нейтронов.
Протон — это частица, которая имеет положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона — p + .
Нейтрон — это частица, не имеющая электрического заряда. Заряд нейтрона равен 0. Символ нейтрона — n 0 .
Протоны и нейтроны имеют общее название — нуклоны.
Ядра атомов имеют положительный заряд, так как состоят из протонов с положительным зарядом и нейтронов. По величине заряд равен количеству протонов в ядре и совпадает с порядковым номером элемента в периодической системе.
Электрон — это частица, которая имеет отрицательный электрический заряд. Заряд электрона в условных единицах равен -1. Символ электрона — e .
Протоны, нейтроны и электроны имеют общее название — элементарные частицы или субатомные частицы.
| Протон | p + | +1 |
| Нейтрон | n 0 | 0 |
| Электрон | e | -1 |
Заряд протона и электрона одинаковы по величине, но противоположны по знаку. Любой атом содержит равное число протонов и электронов, значит заряд ядра и суммарный заряд всех электронов атома одинаковы по величине, но противоположны по знаку. Следовательно, атомы являются электронейтральными частицами.
94 Атома естественного происхождения на Земле
Из 118 известных атомов 94 встречаются в природе, хотя некоторые встречаются в незначительных количествах. Остальные 24 были синтезированы только в лабораториях или ядерных реакторах.
Каждый атом содержит определенное количество протонов в ядре. Например, все атомы натрия содержат 11 протонов, а все атомы серебра содержат 47 протонов.
Изотоп элемента определяется числом нейтронов, а магнитные характеристики зависят от количества электронов в атоме.
Самый большой и самый маленький атом
Самым большим элементом (по размеру) является Франций, но поскольку он крайне нестабилен, предпочтение отдается Цезию. У него большая валентная оболочка и относительно менее эффективный заряд ядра.
Наименьший элемент — гелий, первый в группе благородных газов в периодической таблице. Его атомный радиус примерно в 9 раз меньше диаметра цезия.
Главные правила образования оболочки электронов в атоме

Источник
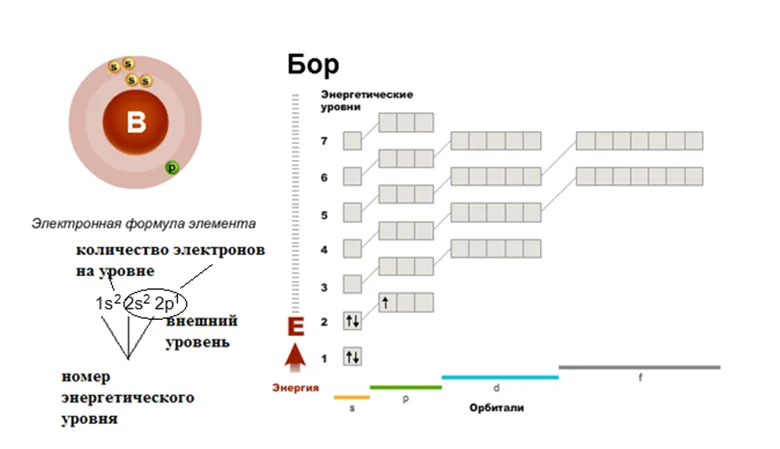
Давайте дадим волю фантазии, допустим, к нашему семиэтажному дому подошёл Бор, не лес как вы могли подумать, а элемент. Смотрим в шпаргалку, как вы уже догадались, это будет периодическая таблица, и ищем там его расположение. Бор занимает ячейку под номером 5. Эта ячейка находится во втором периоде, третьей группе. Значит, число электронов в атоме 5, они размещаются на I и II этажах. Первый уровень будут занимать 2 электрона. Значит на второй этаж (внешний уровень) переходят оставшиеся 3. Два будут занимать s-подуровень, один будет размещаться на р-подуровне. Строение оболочки атома В (бор).
Составим электронную и графическую схему элемента на примере Si и V с помощью алгоритма.

Обратите внимание, чтобы составить электронную формулу элемента, достаточно знать его расположение в ПСХЭ. Итак, начинаем по порядку.
- Кремний, находится под № 14, символ Si.Ar (Si) = 28
- Заряд ядра +14. e = 14, р = 14, n = 28 – 14 = 14
- III период, IV (А)группа.
- Энергетических уровней 3. Не забываем, что следуя правилу Гунда, электроны занимают, ячейку по одному на внешнем p-подуровне
- Исходя с этого всего, электронная оболочка атома записывается в виде формулы

- Ванадий, № 23, символ V.
- Заряд ядра +23. Электронов 23.
- IV период, V(Б) группе.
- Энергетических уровней 4. IV открывает большие периоды, которые имеют свою особенность заполнения. Применив принцип Клечковского, мы увидим, что изначально заполняется 4s-подуровень, а только тогда 3d-подуровень.
- Исходя с этого всего, схема строения электронной оболочки атома запишется в следующем виде.

Существует основное состояние электрона в атоме и возбуждённое, которое возникает, если к атому применить некоторую определённую энергию. Электроны во внешнем электронном слое атома имеют способность перемещаться, занимая место на свободной орбитали, образуя при этом возбуждённое состояние.

Обратите внимание, число неспаренных электронов отвечает валентности элементов: Li (I), Be (II), B (III), C (II и IV).
Периодичность свойств элементов. Электроотрицательность
С развитием учения о строении атома, периодический закон занимает ещё больше значимое место в естествознании. Уже неоднократно говорилось, что ПСХЭ является уникальной подсказкой. Достаточно знать расположение и строение электронных оболочек атомов элементов, и возникает возможность судить о том, какими характеристиками он будет обладать. В настоящее время периодический закон имеет формулировку, данную Менделеевым, с небольшим уточнением.

За то, какими свойствами будет наделён элемент, отвечают электроны, которые размещены на внешнем энергетическом уровне. Их ещё называют валентные электроны атома, именно они отвечают за периодическое изменение свойств элементов.
С увеличением массы атома в пределах периода, количество электронов также возрастает, пока не заполнятся все вакантные ячейки уровня.
В ходе химической реакции происходит «движение» электронов. Т.е. одни элементы будут отдавать их, а вторые принимать.
Электроотрицательность — это способность атома «оттягивать» на себя электронную плотность других атомов
При образовании химических связей, каждый атом стремится «к совершенству», т.е. завершить энергетический уровень. Такой уровень имеют благородные газы ns 2 np 6 . А остальным чтобы получить данную конфигурацию необходимо отдать, либо принять электроны.
Рассмотрим на примере, образования вещества NaCl.

Отдав свой один электрон с внешнего 3s-уровня, атом Натрия образует ион Na + , по своей электронной конфигурации аналогичный Неону. Хлор принимая электрон, образует ион Cl − – принимая электронную конфигурацию Аргона.
Обобщая данный пример, сделаем вывод, элементы, которые содержат малое количество электронов на внешнем уровне (1 – 3) будут только отдавать электроны – и они будут относиться к металлам. Неметаллы характеризуются способностью принимать электроны.

Из определения сделаем вывод, что наибольшую электроотрицательность имеет Фтор (F), нет ни одного элемента, кому бы он смог отдать свой электрон, а будет только забирать. Минимальную ЭО будет иметь Франций (Fr).
Ещё одна важная причина изменения свойств элементов, которая изменяется периодически, это радиус атома. Если ЭО характеризует неметаллы, то по радиусу судят о металлических свойствах. Металлы легко отдают электроны, чем дальше они находятся от ядра, тем легче «отрываются». Радиус атома с увеличением заряда ядра в периоде уменьшается, так как ядро начинает сильнее притягивать электроны.