Вопрос по физике:
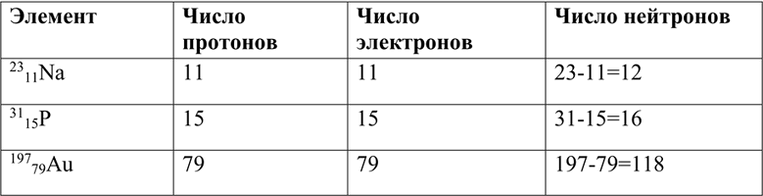
Укажите число протонов Z и нейтронов N, входящих в состав ядра натрия Na
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
- bookmark_border
- 01.07.2017 13:51
- Физика
- remove_red_eye 18967
- thumb_up 25
Ответы и объяснения 2
conemparuthe
₁₁Na²³
протонов Z=11 (по порядковому номеру)
нейтронов N=23-11=12
- 02.07.2017 21:26
- thumb_up 4
bldakily434
Протонов 11, а нейтронов 12
- 03.07.2017 23:00
- thumb_up 25
Знаете ответ? Поделитесь им!
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Физика.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Физика — область естествознания: естественная наука о простейших и вместе с тем наиболее общих законах природы, о материи, её структуре и движении.
Параграф 7 Вопрос 2 ГДЗ Габриелян 8 класс (базовый уровень) (Химия)
*Цитирирование задания со ссылкой на учебник производится исключительно в учебных целях для лучшего понимания разбора решения задания.
*размещая тексты в комментариях ниже, вы автоматически соглашаетесь с пользовательским соглашением
Ионы натрия
Атомы натрия в соединениях проявляют валентность I.
Валентность натрия характеризует способность атома Na к образованию химических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Na
Квантовые числа определяются последним электроном в конфигурации, для атом Na эти числа имеют значение N = 3, L = 0, Ml = 0, Ms = +½
Видео заполнения электронной конфигурации (gif):

Результат:
Электронное строение атома натрия
Электронная конфигурация атома натрия 1s2 2s2 2p6 3s1. Потенциал ионизации (первый электрон) атома натрия равен 495,85 кДж/моль (5,1390769(3) эВ).
Строение атома. Как определить количество протонов, электронов и нейтронов. Нуклонное число.
Строение атома натрия
Атом натрия состоит из положительно заряженного ядра (+11), вокруг которого по трем оболочкам движутся 11 электронов. При этом 10 электронов находятся на внутреннем уровне, а 1 электрон — на внешнем. Поскольку натрий расположен в третьем периоде, оболочек всего три. Первая — внутренняя оболочка представлена s-орбиталью. Вторая — внутренняя оболочка представлена s- и р-орбиталями. Третья — внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома натрия — на 3s-орбитали находится один неспаренный электрон. В свою очередь ядро атома натрия состоит из 11 протонов и 12 нейтронов. Натрий относится к элементам s-семейства. [7]
Физические свойства
При стандартной температуре и давлении металл натрий — серебристо-белого цвета, пластичен, свежий срез натрия блестит. Металлический натрий можно легко разрезать ножом. Он является хорошим проводником электричества и тепла. Из-за низкой атомной массы и большого атомного радиуса натрий занимает третье место по плотности среди всех элементарных металлов и является одним из трех металлов, способных плавать в воде, двумя другими являются литий и калий.

При комнатной температуре натрий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,42820 нм, Z = 2.
При температуре −268 °С (5 К) натрий переходит в гексагональную фазу, пространственная группа P 63/mmc, параметры ячейки a = 0,3767 нм, c = 0,6154 нм, Z = 2. [12]

Положительный тест на воспламеняемость натрия имеет ярко-желтый цвет.
Натрий придает пламени интенсивный желтый цвет. Еще в 1860 году Кирхгоф и Бунзен отметили высокую чувствительность натриевого теста в пламени и заявили в Annalen der Physik und Chemie [13] :
«В углу нашей комнаты площадью 60 м 3, самом дальнем от аппарата, мы взорвали 3 мг хлората натрия с молочным сахаром, наблюдая за неярким пламенем перед щелью. Через некоторое время он засветился ярко-желтым цветом и показал сильную линию натрия, которая исчезла только через 10 минут. Исходя из веса натриевой соли и объема воздуха в помещении, мы легко вычисляем, что одна весовая часть воздуха не может содержать более 1/20 миллионной веса натрия».
Изотопы натрия
Стабильным считается только изотоп 23 Na, хотя науке известно более 20 изотопов натрия.
Изотоп 23 Na образуется в процессе сжигания углерода в звездах путем слияния двух атомов углерода вместе при температуре свыше 600 мегакельвинов и массой звезды не менее трех солнечных. Два радиоактивных космогенных изотопа являются побочным продуктом расщепления космических лучей: 22 Na имеет период полураспада 2,6 года и 24 Na — период полураспада 15 часов; у всех остальных изотопов период полураспада составляет менее одной минуты.
Также учеными были открыты два ядерных изомера, более долговечным из которых является 24m Na с периодом полураспада около 20,2 миллисекунд. [12]
Число протонов, нейтронов, электронов в атоме натрия 23/11Na
Найди верный ответ на вопрос ✅ «Число протонов, нейтронов, электронов в атоме натрия 23/11Na . » по предмету Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Помоги с ответом
Исподьзуя контурную карту на стр 36-37, определите геграфическое положение и подпишите названия Евразиатской, Северо-Американской, Южно-Американской, Антарктической, Индо-Австралийской литосферных плит
Нет ответа
8. Во время подъема в гору скорость велосипедиста, двигающегося прямолинейно и равноускоренно, изменилась за 8 с от 5 м/с до 10,8 км/ч. Чему равен модуль ускорения?
Нет ответа
1) тело отдаёт количество теплоты без изменения агрегатного состояния. Его температура при этом . 2) при увеличении массы тела его удельная теплота сгорания топлива . 3) при уменьшении массы тела количество теплоты требуемое для его нагревания ..
Натрий
На́трий (лат. Natrium), Na, химический элемент I группы короткой формы (1-й группы длинной формы) периодической системы ; атомный номер 11; атомная масса 22,98976928; относится к щелочным металлам . В природе один стабильный изотоп 23 Na. Искусственно получены радиоизотопы с массовыми числами 17–35.
Природные соединения натрия известны с древних времён. В эпоху неолита , приблизительно 5–7 тыс. лет назад, в качестве компонента пищи людей вошла в употребление поваренная соль ( хлорид натрия ) NaCl. В Древнем Египте применяли природную соду ( карбонат натрия ) Na2CO3 как моющее средство, а также для варки стекла . К началу 18 в. в Западной Европе соли натрия широко применялись в медицине, при выделке кож, крашении тканей. В 1807 г. Г. Дэви электролизом расплава едкого натра NaOH впервые получил расплавленный металлический натрий и дал ему название «содиум» (sodium, от позднелат. soda – сода), которое отражает происхождение этого элемента из соды; название сохранилось в США, Великобритании и некоторых других странах. Название «натрий», происходящее от арабского «натрун» (греч. νίτρον) и первоначально относившееся к природной соде, предложено Й. Берцелиусом в 1811 г. и введено в отечественную химическую номенклатуру Г. И. Гессом в 1831 г.
Распространённость в природе

Минерал улексит, борат натрия. Округ Керн (штат Калифорния). Минерал улексит, борат натрия. Округ Керн (штат Калифорния).
Конфигурация внешней электронной оболочки атома натрия 3s 1 ; в соединениях проявляет степень окисления +1; энергии ионизации Na 0 →Na + 495,8 кДж/моль; электроотрицательность по Полингу 0,93; атомный радиус 180 пм, радиус иона Na + 116 пм ( координационное число 6).
Натрий – металл высокой химической активности (хранят под слоем инертной обезвоженной и не содержащей кислорода жидкости – керосина , минеральные масла ; перевозят в запаянных металлических сосудах). В реакциях с различными соединениями (оксидами, галогенидами и пр.) ведёт себя как сильный восстановитель . На воздухе активно окисляется с поверхности, в жидком состоянии при температуре выше 200 °С загорается. В зависимости от условий может окисляться до оксида Na2O или пероксида Na2O2. Энергично реагирует с водой с образованием гидроксида NaOH и H2, за счёт выделяющейся энергии Na плавится; при большой поверхности контакта реакция происходит со взрывом. Натрий воспламеняется в атмосфере фтора , в атмосфере хлора горит при комнатной температуре, с бромом реагирует лишь при нагревании. Энергично взаимодействует с S, Se и Te, образуя халькогениды состава Na2X, NaX, NaX2, Na2X5.
Благородные газы незначительно растворимы в твёрдом и жидком натрии, при температуре 200 °C металл начинает поглощать H2, образуя гидрид NaH. С азотом в электрическом разряде даёт нитрид Na3N или азид NaN3, с разбавленными кислотами – соли. В жидком NH3 легко растворяется, образуя раствор синего цвета с металлической проводимостью, содержащий катионы Na + и сольватированные электроны. Взаимодействием с NH3 при 300–400 °C или в присутствии катализатора при охлаждении до –30 °C получают амид NaNH2. При 800–900 °C газообразный натрий реагирует с углеродом , образуя карбид (ацетиленид) Na2C2. Реакцией натрия с ацетиленом при 98 °С получают NaCCH и этилен , при более высоких температурах – Na2C2. С графитом натрий образует соединения включения. Натрий реагирует с донорами протонов ( спиртами , карбоновыми кислотами и др.), давая производные со связью C─O─Na (например, натриевые соли высших жирных кислот – мыла́ ). Входит в состав натрийорганических соединений .
Со многими металлами (Ag, Au, Cd, Ga, Tl, Sn, Pb, Sb, Bi, K, Cs) образует интерметаллиды ; не образует соединений с Ba, Sr, Mg, Li, Zn, Al. C ртутью даёт амальгамы – интерметаллиды состава NaHg2, NaHg, Na3Hg2 и др. (наибольшее значение имеют жидкие амальгамы).
При работе с натрием необходимо учитывать его высокую реакционную способность, в том числе способность загораться при контакте с водой. Натрий разъедает кожу, вызывает ожоги . В целях безопасности необходимо использовать резиновые перчатки, защитные очки или маску. С большим количеством натрия следует работать в специальных камерах, в инертной атмосфере ( аргон , азот ). Для тушения горящего натрия применяют поваренную соль, песок .
Состав ядра натрия
Вместе с протонами в ядре натрия находится также некоторое количество нейтронов. Нейтроны — это нейтральные частицы, которые, как и протоны, являются элементарными. Они не имеют электрического заряда и влияют на ядерные свойства атома.
Точное количество нейтронов в ядре натрия зависит от его изотопа. Наиболее распространенный изотоп натрия имеет массовое число 23 и обычно содержит 12 нейтронов. Однако существуют и другие изотопы натрия, у которых число нейтронов может варьироваться, что приводит к изменению их ядерных свойств.
Таким образом, состав ядра натрия включает 11 протонов и разное количество нейтронов, в зависимости от его изотопа. Эти частицы взаимодействуют друг с другом и определяют химические и физические свойства атома натрия.
Количество протонов в ядре натрия
Для определения количества нейтронов в ядре натрия необходимо вычесть количество протонов из общего числа нуклонов в ядре. У натрия атомный номер равен 11, что указывает на количество протонов в его ядре. Узнать общее число нуклонов (протонов и нейтронов) можно из массового числа элемента, которое для натрия равно 23.
Таким образом, вычислим количество нейтронов: общее число нуклонов (23) минус количество протонов (11). Получаем, что в ядре натрия содержится 12 нейтронов.