Величина заряда дана в кулонах, масса — в килограммах (единицах СИ); слова «спин» и «статистика» будут пояснены ниже.
Обратим внимание на различие в массе частиц: протоны и нейтроны почти в 2000 раз тяжелее электронов. Следовательно, масса любого тела почти целиком определяется массой протонов и нейтронов.
Нейтрон, как это следует из его названия, нейтрален — его заряд равен нулю. А протон и электрон имеют одинаковые по величине, но противоположные по знаку заряды. Электрон заряжен отрицательно, а протон — положительно.
Среди характеристик частиц нет, казалось бы, важной характеристики — их размера. Описывая строение атомов и молекул, электроны, протоны и нейтроны можно считать материальными точками. О размерах протона и нейтрона придется вспомнить только при описании атомных ядер. Даже по сравнению с размерами атомов протоны и нейтроны чудовищно малы (порядка 10 -16 метра).
По сути дела, этот короткий раздел сводится к представлению электронов, протонов и нейтронов как строительного материала всех тел в природе. Можно было бы просто ограничиться таблицей 1, однако нам предстоит понять, каким образом из электронов, протонов и нейтроновосуществляется постройка, что заставляет частицы объединяться в более сложные конструкции и каковы эти конструкции .
АТОМ — НАИБОЛЕЕ ПРОСТАЯ ИЗ СЛОЖНЫХ КОНСТРУКЦИЙ
Атомов много. Оказалось необходимым и возможным упорядочить их специальным образом. Упорядочение дает возможность подчеркнуть различие и сходство атомов. Разумное расположение атомов — заслуга Д. И. Менделеева (1834-1907), который сформулировал периодический закон, носящий его имя. Если временно отвлечься от существования периодов, то принцип расположения элементов крайне прост: они располагаются последовательно по весу атомов. Самый легкий — атом водорода. Последний природный (не созданный искусственно) атом — атом урана, который тяжелее его в 200 с лишним раз.
Понимание строения атомов объяснило наличие периодичности в свойствах элементов.
В самом начале XX века Э. Резерфорд (1871-1937) убедительно показал, что почти вся масса атома сосредоточена в его ядре — небольшой (даже по сравнению с атомом) области пространства: радиус ядра приблизительно в 100 тысяч раз меньше размера атома. Когда Резерфорд производил свои эксперименты, еще не был открыт нейтрон. С открытием нейтрона было понято, что ядра состоят из протонов и нейтронов, а атом естественно представлять себе как ядро, окруженное электронами, число которых равно числу протонов в ядре — ведь в целом атом нейтрален. Протоны и нейтроны, как строительныйматериал ядра, получили общее название — нуклоны(с латинского nucleus — ядро). Этим названием мы и будем пользоваться.
Количество нуклонов в ядре принято обозначать буквой А. Ясно, что А = N + Z, где N — число нейтронов в ядре, а Z — число протонов, равное числу электронов в атоме. Число А носит название атомной массы, а Z — атомного номера. Атомы с одинаковыми атомными номерами называют изотопами: в таблице Менделеева они находятся в одной клеточке (по-гречески изос — равный, топос — место). Дело в том, что химические свойства изотопов почти тождественны. Если таблицу Менделеева рассмотреть внимательно, можно убедиться, что, строго говоря, расположение элементов соответствует не атомной массе, а атомному номеру. Если элементов около 100, то изотопов более 2000. Правда, многие из них неустойчивы, то есть радиоактивны (от латинского radio — излучаю, activus — деятельный), они распадаются, испуская различные излучения.
Опыты Резерфорда не только привели к открытию атомных ядер, но и показали, что в атоме действуют те же электростатические силы, которые отталкивают друг от друга одноименно заряженные тела и притягивают друг к другу разноименно заряженные (например, шарики электроскопа).
Атом устойчив. Следовательно, электроны в атоме движутся вокруг ядра: центробежная сила компенсирует силу притяжения. Понимание этого привело к созданию планетарной модели атома, в которой ядро — Солнце, а электроны — планеты (с точки зрения классической физики, планетарная модель непоследовательна, но об этом ниже).
Есть целый ряд способов оценить размер атома. Разные оценки приводят к близким результатам: размеры атомов, конечно, различны, но приблизительно равны нескольким десятым нанометра (1 нм = 10 -9 м).
Рассмотрим для начала систему электронов атома.
В Солнечной системе планеты притягиваются к Солнцу силой гравитации. В атоме действует электростатическая сила. Ее часто называют кулоновской в честь Шарля Огюстена Кулона (1736-1806), установившего, что сила взаимодействия между двумя зарядами обратно пропорциональна квадрату расстояния между ними. Тот факт, что два заряда Q1 и Q2 притягиваются или отталкивают ся с силой, равной FC = Q1Q2/r 2 , где r — расстояние между зарядами, носит название «Закон Кулона». Индекс «С» присвоен силе F по первой букве фамилии Кулона (по-французски Coulomb ). Среди самых различных утверждений мало найдется таких, которые столь же справедливо названы законом, как закон Кулона: ведь область его применимости практически не ограничена. Заряженные тела, каких бы они ни были размеров, а также атомные и даже субатомные заряженные частицы — все они притягиваются или отталкиваются в согласии с законом К
Fatal error: Uncaught Error: Call to undefined function set_magic_quotes_runtime() in /www/htdocs/1dbcf2b3552b065fc49d8747114db86c/sape.php:262 Stack trace: #0 /www/htdocs/1dbcf2b3552b065fc49d8747114db86c/sape.php(343): SAPE_base->_read(‘/www/htdocs/1db. ‘) #1 /www/htdocs/1dbcf2b3552b065fc49d8747114db86c/sape.php(418): SAPE_base->load_data() #2 /www/htdocs/links.html(7): SAPE_client->SAPE_client() #3 /www/htdocs/happy_physics/kaganov4.html(128): include(‘/www/htdocs/lin. ‘) #4 thrown in /www/htdocs/1dbcf2b3552b065fc49d8747114db86c/sape.php on line 262
Химические элементы
Химический элемент — совокупность атомов с одним и тем же зарядом ядра, числом протонов в ядре и электронов в электронной оболочке. Закономерную связь химических элементов отражает периодическая таблица Д.И. Менделеева.

- Обозначение химического элемента
- Русское наименование
- Порядковый номер = заряд атома = число электронов = число протонов
- Атомная масса
- Распределение электронов по энергетическим уровням
- Электронная конфигурация внешнего уровня
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов равно числу электронов.

Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия, кислорода, меди. Решение вы найдете ниже.

Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Изотопы (греч. isos — одинаковый + topos — место) — общее название разновидностей одного и того же химического элемента, имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
Вероятно, вы не задумывались, но вся таблица Д.И. Менделеева и представленные в ней химические элементы — это самые распространенные на земле изотопы.
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.

В таблице Д.И. Менделеева представлен самый распространенный из трех — протий. Он содержит 1 протон и 1 электрон, нейтроны отсутствуют. У дейтерия 1 протон, 1 нейтрон и 1 электрон. У трития 1 протон, 2 нейтрона, 1 электрон.
Теперь очевидно, что изотопы — атомы одного и того же химического элемента, различающиеся числом нейтронов.
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который включен в таблицу Д.И. Менделеева.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Химические элементы
Состав ядра атома
Ядро атома состоит из нуклонов. Нуклоны в ядре — это протоны и нейтроны. Массы протона и нейтрона почти одинаковые. Заряд ядра атома обозначается знаком «+» и зависит исключительно от количества протонов, ведь протоны — это носители положительного заряда, а нейтроны заряда не имеют никогда. Почти вся масса атома сконцентрирована в ядре, поэтому оно супер-тяжелое по отношению к остальному содержимому атома, однако, очень маленькое по сравнению с общим размером атома.
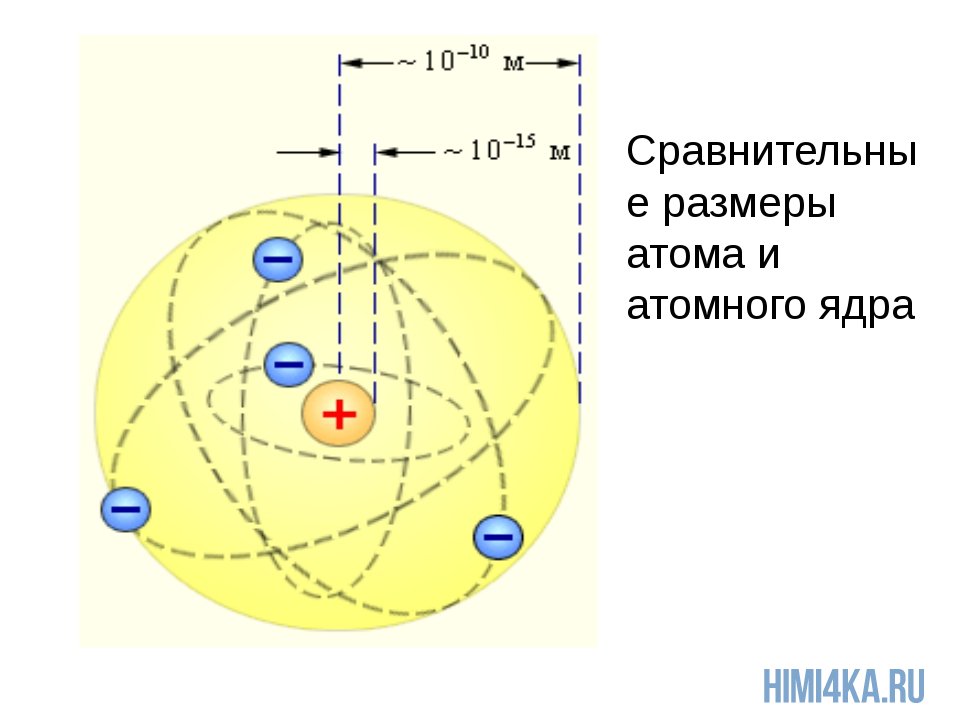
Чтобы вы понимали насколько оно мало, приведу пример: если атом увеличить до размеров Земли, то ядро атома будет в диаметре всего 60 метров. Надеюсь, что теперь у вас возникло некоторое представление об основах строения атома и составе атомного ядра.
Атомная единица массы
Весы, которые могли бы взвесить атом, электрон или нуклон, пока еще не изобрели. Поэтому химики выражают массу частиц не в граммах, а в атомных единицах массы (а.е.м.). 1 атомная единица массы равна 1/12 массы атома углерода, ядро которого состоит из 6 протонов и 6 нейтронов. Получается, что масса 1 протона ~ 1 нейтрона ~ 1 а.е.м. Возникает вопрос, почему мы не считали 6 электронов, однако ответ будет простым: масса электрона ничтожно мала , поэтому в данном случае с ней даже не считаются.

Перевод граммов в атомные единицы массы выглядит так: 1 гр = 6,022×10 23 а.е.м и наоборот 1 а.е.м. = 1,66×10 -24 г. Число 6,022×10 23 носит название — число Авогадро N (позже мы рассмотрим способ ее вычисления). Ниже изображена сравнительная таблица зарядов и масс элементарных частиц:
| Название | Заряд, Кл | Масса, гр | Масса, а.е.м. |
| Протон | +1,6·10 -19 | 1,67·10 -24 | 1,00728 |
| Нейтрон | 0 | 1,67·10 -24 | 1,00866 |
| Электрон | -1,6·10 -19 | 9,10·10 -28 | 0,00055 |
Строение атома
Атом — это электронейтральная частица, состоящая из положительно заряженного ядра и электронной оболочки.
В состав ядра входят нуклоны, или ядерные частицы. Это протоны и нейтроны. Электронная оболочка образована электронами. Протоны, нейтроны и электроны называют элементарными частицами атома.
Нуклоны в ядре удерживаются ядерным взаимодействием, энергия которого намного больше энергии химической связи. Поэтому в химических реакциях ядра не разрушаются.
Протон ((p)) — это частица с относительным зарядом (+1) и относительной массой (1).
Нейтрон ((n)) не имеет заряда, а его относительная масса тоже равна (1).
Электрон ( e − ) имеет заряд (-1), а его масса в (1837) раз меньше массы протона и нейтрона.
Строение атома можно охарактеризовать по положению химического элемента в периодической системе.
Порядковый номер элемента равен заряду ядра, числу протонов в ядре и числу электронов в его электронной оболочке.
Учитывая, что масса атома в основном сосредоточена в ядре и масса каждого нуклона равна (1), можно определить число нейтронов. Для этого от массового числа нужно отнять число протонов (порядковый номер).
порядковый номер радия Ra (88), относительная атомная масса равна (226). Значит, в атоме содержится (88) протонов и (88) электронов, а число нейтронов равно (226 — 88 = 138).
Число нейтронов в атомах одного элемента непостоянно. Поэтому атомы одного химического элемента могут различаться своими массами и существуют в виде разных нуклидов (изотопов).
Изотопы (нуклиды) — разновидности атомов с одинаковым зарядом ядра, но разными массами.
Изотопы с одинаковым зарядом ядра составляют химический элемент. Их обозначают, указывая справа вверху от символа элемента массовое число. Справа внизу часто записывают также протонное число (порядковый номер): O 8 16 , O 8 17 .
Большинство химических элементов в природе представлено несколькими разновидностями атомов. Всего их известно более (2500).
водород в природе представлен тремя изотопами. Ядро самого лёгкого изотопа (протия) состоит только из одного протона. В ядре дейтерия один протон и один нейтрон, а в ядре трития один протон и два нейтрона.
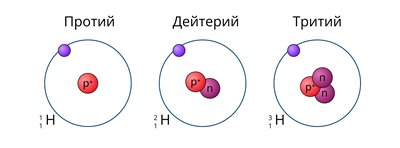
Рис. (1). Изотопы водорода
Указанная в периодической системе относительная атомная масса — это средняя масса всех существующих в природе изотопов данного элемента. Когда мы её округляем до целых, то получаем массу самого распространённого изотопа.
Нахождение числа нейтронов, протонов и электронов в атоме .
Атом состоит из ядра и вращающихся вокруг ядра электронов.
Ядро состоит из протонов и нейтронов
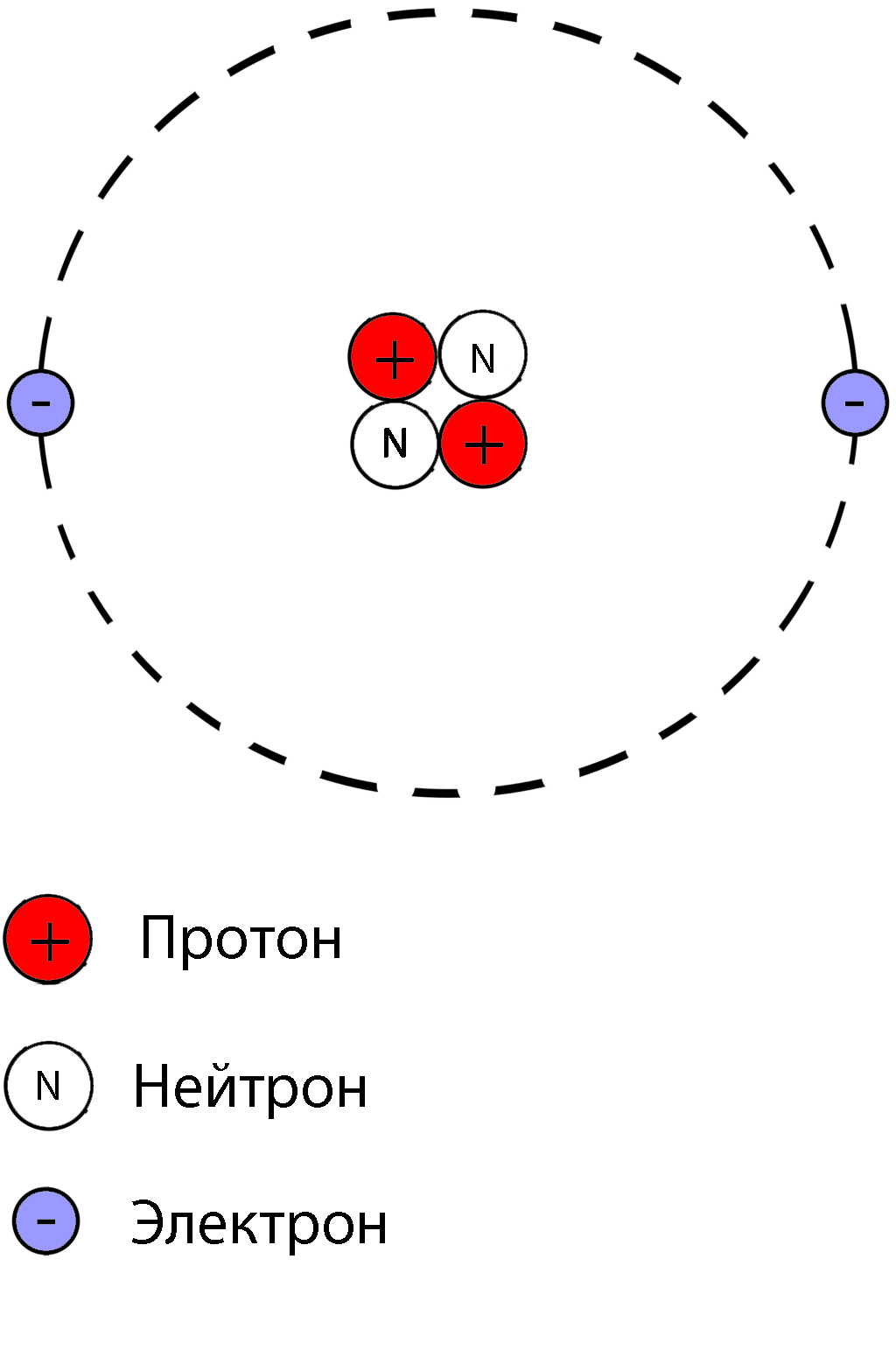
Протон- положительно заряженная частица
масса протона равна единице, заряд протона равен единице
Нейтрон-нейтральная частица
масса нейтрона равна единице, заряд нейтрона равен нулю
Электрон- отрицательно заряженная частица
Заряд электрона равен -1, а масса электрона равна нулю
Порядковый номер элемента в таблице Менделеева указывает на число электронов в атоме
Количество протонов в атоме равно количеству электронов , так как атом электрически нейтрален
Масса атома складывается из числа протонов и числа нейтронов, масса электрона не учитывается
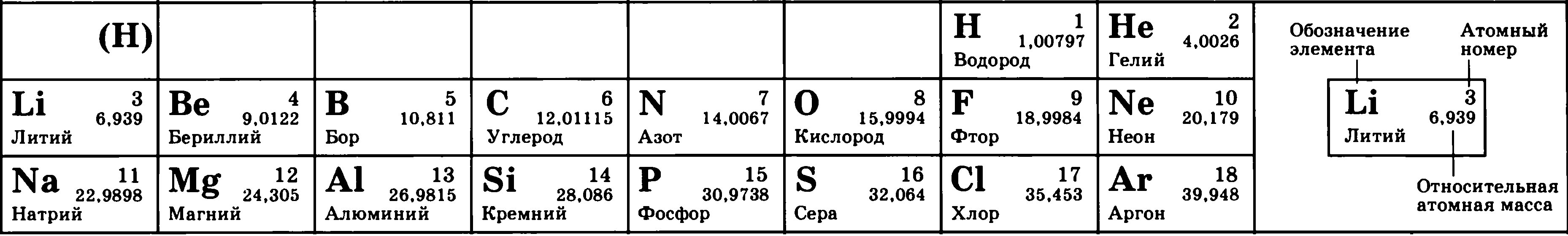
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов в атоме водорода
После чего начертим модель атома водорода
Порядковый номер атома водорода равен единице, значит атом имеет:
1 электрон
1 протон
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома водорода равна единице
В атоме водорода нет нейтронов
Модель атома водорода:
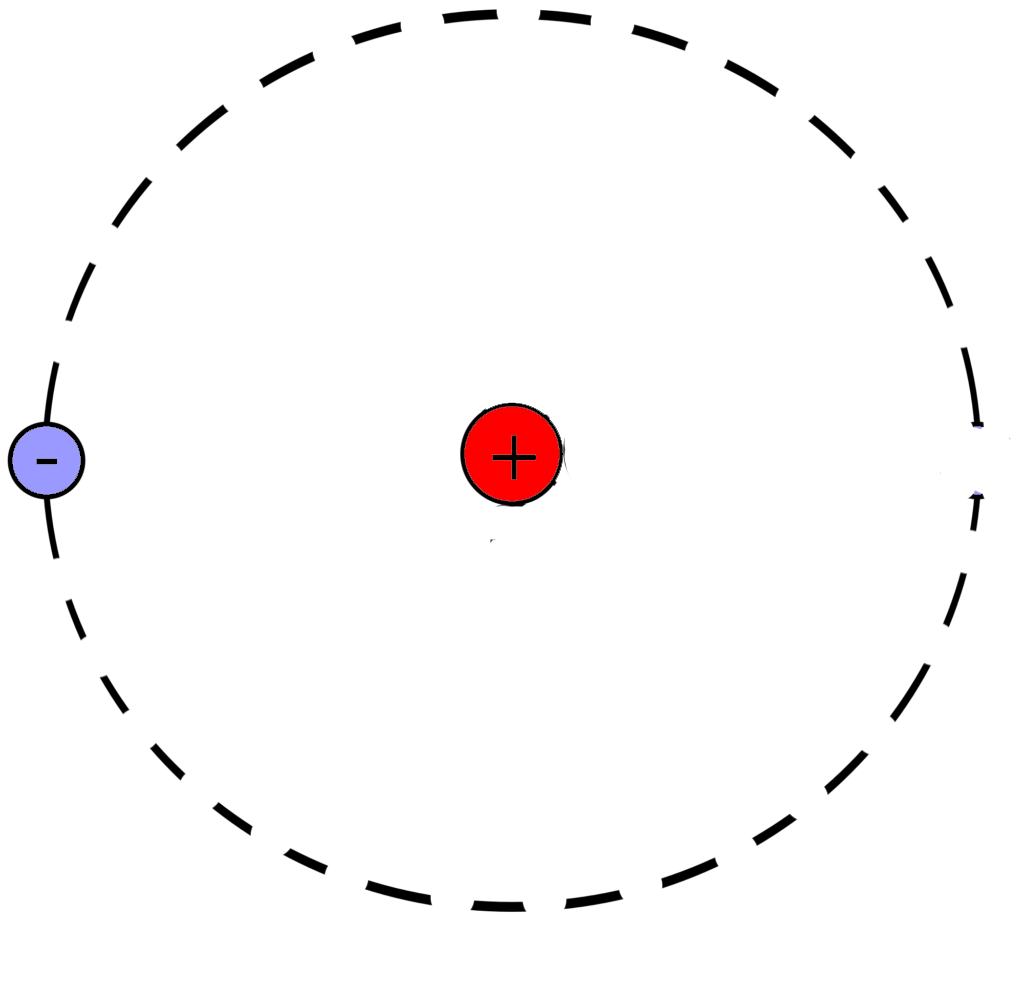

Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов в атоме гелия
После чего начертим модель атома гелия
Порядковый номер атома гелия равен 2, значит атом имеет:
2 электрона
2 протона
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома гелия равна 4
В атоме гелия 2 нейтрона
Модель атома гелия:
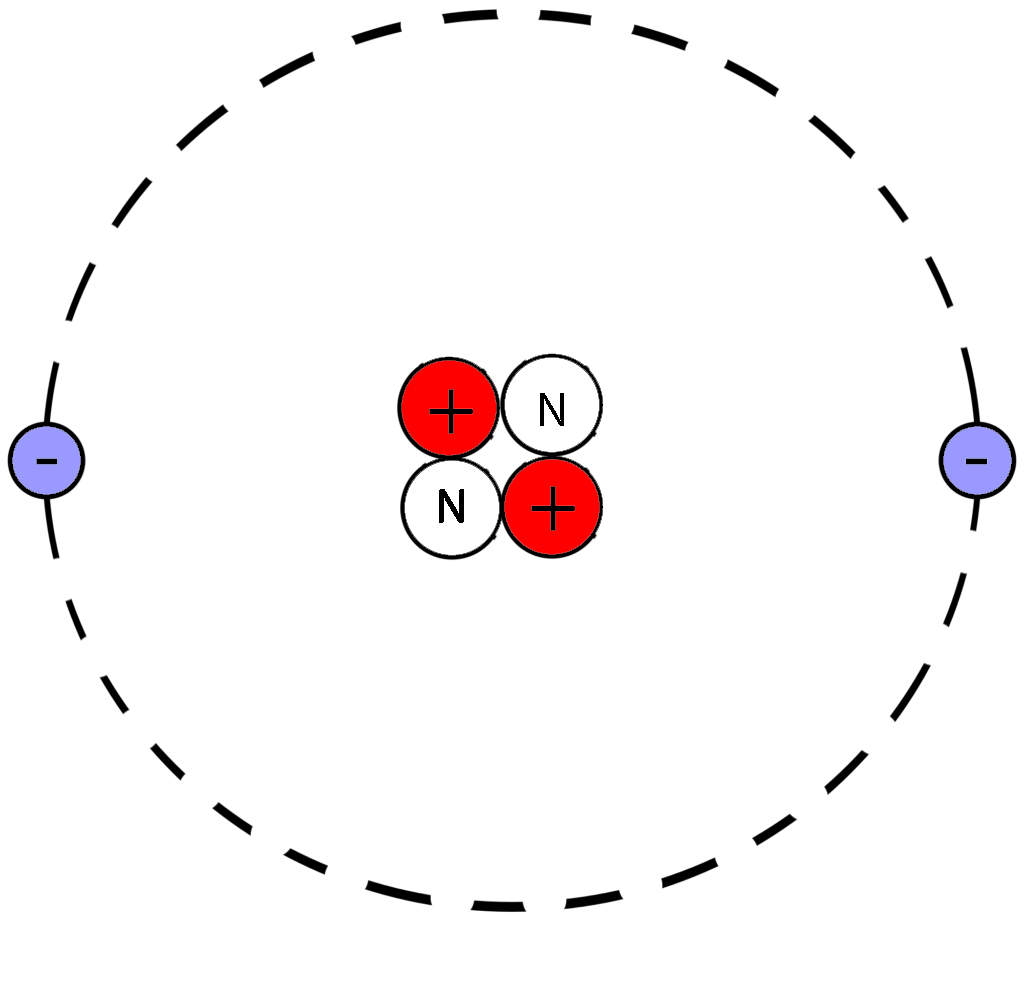

С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме лития
Массу атома округлить до 7.
Ответ: 3 протона 3 электрона 4 нейтрона
Электронные конфигурации атомов и ионов
Помимо определения общего числа электронов в атоме, важно также знать, как эти электроны распределены по электронным слоям и орбиталям. Это распределение называется электронной конфигурацией и записывается в виде:
Здесь цифры перед буквами обозначают номер электронного слоя (1, 2, 3. ), буквы s, p, d — тип орбитали, а цифры после букв — число электронов на данной орбитали. Чтобы построить электронную конфигурацию, нужно знать порядок заполнения орбиталей:
- 1s2;
- 2s, 2p6;
- 3s2, 3p6, 3d;
- 4s2, 4p, 4d и т.д.
Валентные электроны
Особое значение имеют валентные электроны на внешнем слое атома. Именно они определяют химические свойства элемента и его валентность — способность образовывать химические связи.
Например, для атома азота электронная конфигурация — 1s22s22p3. Здесь внешний слой — 2p, на котором находится 3 неспаренных электрона. Это и есть валентные электроны.
Атомы
Атом — это мельчайшая химически неделимая частица вещества, а также наименьшая часть химического элемента, являющаяся носителем его свойств. Химически неделимая означает, что атом в ходе химических реакций не делится на более мелкие части.
Атомы очень маленькие частицы, их размер находится в диапазоне от одного до пяти ангстрем (обозначается — Å.). Один ангстрем — это 10 –10 метра.
Состав и строение атомов
Атомы состоят из ещё более мелких частиц.
В центре любого атома находится положительно заряженное ядро. В пространстве вокруг ядра находятся отрицательно заряженные частицы — электроны, которые образуют так называемое электронное облако . Таким образом, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Пример. Атом гелия состоит из ядра, в котором находятся два протона и два нейтрона, и двух электронов:

Ядро атома — это центральная часть атома, в которой сосредоточена основная его масса и весь положительный электрический заряд. Ядро атома состоит из протонов и нейтронов.
Протон — это частица, которая имеет положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона — p + .
Нейтрон — это частица, не имеющая электрического заряда. Заряд нейтрона равен 0. Символ нейтрона — n 0 .
Протоны и нейтроны имеют общее название — нуклоны.
Ядра атомов имеют положительный заряд, так как состоят из протонов с положительным зарядом и нейтронов. По величине заряд равен количеству протонов в ядре и совпадает с порядковым номером элемента в периодической системе.
Электрон — это частица, которая имеет отрицательный электрический заряд. Заряд электрона в условных единицах равен -1. Символ электрона — e .
Протоны, нейтроны и электроны имеют общее название — элементарные частицы или субатомные частицы.
| Протон | p + | +1 |
| Нейтрон | n 0 | 0 |
| Электрон | e | -1 |
Заряд протона и электрона одинаковы по величине, но противоположны по знаку. Любой атом содержит равное число протонов и электронов, значит заряд ядра и суммарный заряд всех электронов атома одинаковы по величине, но противоположны по знаку. Следовательно, атомы являются электронейтральными частицами.