✓ В переводе с греческого «атом» означает «неделимый». Соответствует ли это действительности?
Да, это соответствует действительности. Атом — это наименьшая электронейтральная частица химического элемента, состоящая из ядра и электронной оболочки.
Проверьте свои знания
1. Какие элементарные частицы составляют ядро атома? Как определить заряд ядра атома, количество протонов в ядре, количество нейтронов, массовое число элемента?
Ядро атома образовано элементарными частицами двух видов: протонами и нейтронами.
Заряд ядра атома численно равен количеству протонов.
Число протонов в ядре равно числу электронов в электронной оболочке.
Количество нейтронов можно рассчитать по формуле: массовое число − количество протонов.
Масса ядра атома численно равна сумме протонов и нейтронов. Эту величину называют массовым числом атома.
2. Сравните между собой элементарные частицы, т. е. найдите общее и различия между протоном и нейтроном, протоном и электроном.
Сравним между собой элементарные частицы.
Протон:
1) Масса: 1,67 * $10^$ кг.
2) Заряд: +1.
3) Число протонов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева
Нейтрон:
1) Масса: 1,67 * $10^$ кг.
2) Заряд: 0.
3) Число нейтронов в атоме находят по формуле N = A – Z, где A − это массовое число, Z − количество протонов.
Электрон:
1) Масса: 9,11 * $10^$ кг.
2) Заряд: −1.
3) Число электронов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева.
3. Что называют изотопами? Запишите обозначения изотопов водорода, хлора и калия.
Атомы одного химического элемента, содержащие различное число нейтронов в ядре и, следовательно, имеющие различные массовые числа, называются изотопами.
$^_$Cl, $^_$Cl − обозначение изотопов хлора.
$^_$H, $^_$H, $^_ $H − обозначение изотопов водорода.
$^_ $K, $^_$K − обозначение изотопов калия.
Определение заряда ядра
Ядро атома состоит из протонов и нейтронов. Протоны имеют положительный элементарный заряд, равный +1. Нейтроны не имеют заряда. Поэтому заряд ядра численно равен количеству протонов в ядре:
- Заряд ядра = Количество протонов
Например, у водорода в ядре 1 протон. Значит, заряд ядра водорода равен +1. У углерода в ядре 6 протонов, соответственно заряд ядра углерода равен +6.

Связь заряда ядра и порядкового номера элемента
В периодической системе химических элементов каждому элементу присвоен порядковый номер. Этот номер показывает количество протонов в ядре атома данного элемента. Поэтому заряд ядра элемента всегда численно равен его порядковому номеру.
Химия 8 класс (Урок№26 — Строение атома. Состав атомных ядер. Изотопы.)
Например, у натрия порядковый номер 11. Это означает, что в ядре атома натрия 11 протонов. Следовательно, заряд ядра натрия равен +11.
Заряд ядра химического элемента = Порядковый номер элемента в периодической системе
Как определить заряд ядра по числу протонов
Итак, заряд любого атомного ядра численно равен количеству содержащихся в нем протонов. Это позволяет легко вычислить величину заряда, зная протонное число ядра, обозначаемое латинской буквой Z. Например:
- У ядра водорода Z=1 — значит, в нем 1 протон и 0 нейтронов;
- У ядра гелия Z=2 — соответственно 2 протона;
- Ядро с Z=79 (золото) содержит 79 протонов.
Так проще всего определить заряд ядра — посмотреть по таблице значение Z для данного химического элемента.
Заряд ядра и порядковый номер элемента
Любопытно, что протонное число Z численно равно порядковому номеру химического элемента в Периодической системе. Это неслучайное совпадение. Дело в том, что именно протонное число ядра определяет число электронов в нейтральном атоме и, как следствие, его химические свойства.
Порядковый номер показывает положение элемента в Периодической таблице, отражая закономерное изменение свойств элементов с ростом числа электронов в атоме. А это число электронов как раз и задается зарядом ядра, равным количеству протонов Z.

Электроны в атоме
Давайте рассмотрим, какое место занимают электроны в атоме. Если ядро составляет 99,86 % от массы, а, как известно, что количество протонов и электронов равно. То на долю электронов приходится всего 0,14% от массы.
На данный момент, электрон считают элементарной частицей.
Модель Резерфорда (планетарная) на очень примитивном уровне даёт представление,как располагаются электроны и протоны в атоме, поскольку атом имеет достаточно сложное строение.
Электрон настолько мал и находится в постоянном движении с достаточно большой скоростью, что зафиксировать его в определённом месте и времени сложно. Именно по этой причине говорят, что электрон в атоме находится не в заданной точке, а может там предположительно находиться, потому что его зафиксировать в определённый момент времени невозможно.

Ядро атома Водорода имеет 1 протон, вокруг которого вращается один электрон. Но как быть, если количество электронов в атоме будет два и более, каким образом они будут размещаться.
Поскольку они двигаются с достаточной большой скоростью, то чтобы указать распределение электронов в атоме используют 4 числа – орбитальные характеристики.
Прежде чем, мы перейдём к орбитальным характеристикам, давайте представим многоэтажный дом, в который необходимо разместить жителей, в нашем случае – это электроны.
Первая орбитальная характеристика

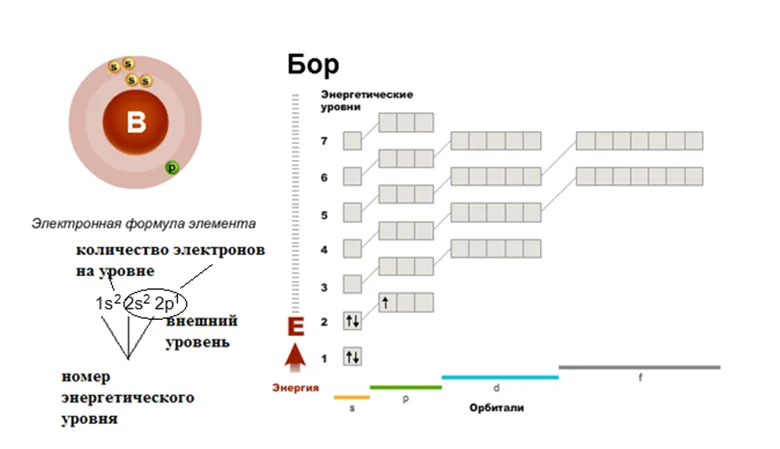
Другими словами, представляем, что наш многоэтажный дом содержит 7 этажей. Цифры 1, 2, 3, 4, 5, 6, 7 обозначают номер этажа или энергетические уровни электрона в атоме.
Вторая орбитальная характеристика

Возвращаемся к нашему, многоэтажному дому, орбитальное число показывает типы орбиталей или в сравнении с домом квартиры s, p, d и f.
Третья орбитальная характеристика

Представить квартиру, в виде ячейки или квадрата, так вот магнитное квантовое число указывает число орбиталей.

Смотрим, на первом этаже размещается только s-квартиры, которые будут однокомнатными. На втором этаже уже имеется две квартиры s и р, т.е. однокомнатная и трёхкомнатная. На третьем этаже s, p, d. Четвёртый, пятый и шестой этажи размещают 4 квартиры s, p, d и f.
Четвёртая орбитальная характеристика

Это означает, что в одной ячейке (квадрате), может поселиться не больше двух электронов.
Вот на таком достаточно примитивном уровне, мы рассмотрели состояние электронов в атоме. Но как они там располагаются? Каждый электрон занимает своё определённое место, согласно энергии.
Рассмотрим распределение электронов по энергетическим уровням в атоме. Наверняка вы заметили, что наш дом семиэтажный. Как думаете, по какой причине? ПСХЭ содержит 7 периодов (7 этажей). Если элемент находится во втором периоде, значит, его электроны будут занимать 1 и 2 этаж и никаким образом не могут попасть на 5 или 6 этажи. В данном примере 2 этаж будут называть внешним, научным языком – внешним энергетическим уровнем (он крайний).
Главные правила образования оболочки электронов в атоме

Источник
Давайте дадим волю фантазии, допустим, к нашему семиэтажному дому подошёл Бор, не лес как вы могли подумать, а элемент. Смотрим в шпаргалку, как вы уже догадались, это будет периодическая таблица, и ищем там его расположение. Бор занимает ячейку под номером 5. Эта ячейка находится во втором периоде, третьей группе. Значит, число электронов в атоме 5, они размещаются на I и II этажах. Первый уровень будут занимать 2 электрона. Значит на второй этаж (внешний уровень) переходят оставшиеся 3. Два будут занимать s-подуровень, один будет размещаться на р-подуровне. Строение оболочки атома В (бор).
Составим электронную и графическую схему элемента на примере Si и V с помощью алгоритма.

Обратите внимание, чтобы составить электронную формулу элемента, достаточно знать его расположение в ПСХЭ. Итак, начинаем по порядку.
- Кремний, находится под № 14, символ Si.Ar (Si) = 28
- Заряд ядра +14. e = 14, р = 14, n = 28 – 14 = 14
- III период, IV (А)группа.
- Энергетических уровней 3. Не забываем, что следуя правилу Гунда, электроны занимают, ячейку по одному на внешнем p-подуровне
- Исходя с этого всего, электронная оболочка атома записывается в виде формулы

- Ванадий, № 23, символ V.
- Заряд ядра +23. Электронов 23.
- IV период, V(Б) группе.
- Энергетических уровней 4. IV открывает большие периоды, которые имеют свою особенность заполнения. Применив принцип Клечковского, мы увидим, что изначально заполняется 4s-подуровень, а только тогда 3d-подуровень.
- Исходя с этого всего, схема строения электронной оболочки атома запишется в следующем виде.

Существует основное состояние электрона в атоме и возбуждённое, которое возникает, если к атому применить некоторую определённую энергию. Электроны во внешнем электронном слое атома имеют способность перемещаться, занимая место на свободной орбитали, образуя при этом возбуждённое состояние.

Обратите внимание, число неспаренных электронов отвечает валентности элементов: Li (I), Be (II), B (III), C (II и IV).
Протоны
Протоны – это положительно заряженные частицы, которые находятся в ядре атома. Они имеют элементарный положительный заряд, равный +1. Протоны обладают массой, примерно равной массе нейтрона, и являются одной из основных составляющих атомного ядра.
Количество протонов в атоме определяет его атомный номер и определяет его химические свойства. Например, атом с одним протоном – водородный атом, атом с двумя протонами – гелиевый атом и так далее.
Протоны также играют важную роль в химических реакциях. Они определяют заряд атома и его способность взаимодействовать с другими атомами. Протоны взаимодействуют с электронами, создавая электростатическое притяжение, которое удерживает электроны вокруг ядра.
Протоны также могут быть ионами, то есть атомами, которые имеют недостаток или избыток протонов, что приводит к изменению их заряда. Ионы с положительным зарядом называются катионами, а ионы с отрицательным зарядом – анионами.
Нейтроны
Нейтроны – это нейтральные частицы, которые находятся в ядре атома вместе с протонами. Они не имеют заряда, поэтому их называют нейтральными. Нейтроны имеют массу, примерно равную массе протона, и их количество в ядре определяет массовое число атома.
Нейтроны играют важную роль в стабильности ядра атома. Они помогают удерживать протоны вместе, преодолевая электростатическое отталкивание между положительно заряженными протонами. Благодаря наличию нейтронов, ядро атома становится более стабильным и менее склонным к распаду.
Нейтроны также могут быть вовлечены в ядерные реакции. Они могут быть захвачены другими атомами или испытывать распад, что приводит к изменению элемента и образованию новых атомов.
Нейтроны
Нейтроны – это нейтральные частицы, которые находятся в ядре атома вместе с протонами. Они не имеют заряда, поэтому их называют нейтральными. Нейтроны имеют массу, примерно равную массе протона, и их количество в ядре определяет массовое число атома.
Нейтроны играют важную роль в стабильности ядра атома. Они помогают удерживать протоны вместе, преодолевая электростатическое отталкивание между положительно заряженными протонами. Благодаря наличию нейтронов, ядро атома становится более стабильным и менее склонным к распаду.
Нейтроны также могут быть вовлечены в ядерные реакции. Они могут быть захвачены другими атомами или испытывать распад, что приводит к изменению элемента и образованию новых атомов.
Электроны
Электроны – это элементарные частицы, которые обращаются вокруг ядра атома. Они имеют отрицательный электрический заряд и очень малую массу по сравнению с протонами и нейтронами.
Электроны находятся в разных энергетических уровнях, которые называются электронными оболочками. Каждая оболочка может содержать определенное количество электронов. Первая оболочка может содержать до 2 электронов, вторая – до 8 электронов, третья – до 18 электронов и так далее.
Электроны внешней оболочки, называемой валентной оболочкой, играют важную роль в химических реакциях. Они могут образовывать связи с электронами других атомов, образуя молекулы. Количество электронов в валентной оболочке определяет химические свойства атома и его способность образовывать связи с другими атомами.
Электроны также могут поглощать или испускать энергию в виде фотонов, что приводит к электромагнитному излучению, такому как свет или радиоволны.
Как определить заряд ядра атома химического элемента
8(800) 333 58 91
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/2/ava/thumbnails/qYIsb3Bdhb458iZ.jpg)
Меня зовут Кузьмин Владимир Александрович.
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Укажите реальные данные, иначе мы не сможем с вами связаться! Отправляя форму, Вы принимаете Условия использования и даёте Согласие на обработку персональных данных
Отправить заявку
Основы химии

Данный курс предназначен для тех, кто желает более подробно познакомиться с такой замечательной наукой, как химия и углубить свои знания.
Мы рекомендуем его учителям химии средней школы, репетиторам химии и ученикам профильных классов.
Курс состоит из разделов, каждый из которых посвящён определённой теме. Разделы рекомендуется изучать по порядку. Пока не все темы Вы сможете найти здесь, так как курс только начал пополняться материалами. В разделах особое внимание уделяется спорным теоретическим и методологическим моментам, а также распространённым заблуждениям некоторых авторов.
С уважением, Кузьмин Владимир Александрович.