В данной статье рассматривается структура атома, его составные части – протоны, нейтроны и электроны, а также свойства ядра и изотопы.
Ядро атома: строение, силы и загадки обновлено: 6 октября, 2023 автором: Научные Статьи.Ру
Помощь в написании работы
Добро пожаловать на лекцию по химии! Сегодня мы будем изучать структуру атома и его основные компоненты. Атом – это основная единица вещества, из которого состоят все вещества в нашей вселенной. Понимание структуры атома поможет нам лучше понять, как происходят химические реакции и взаимодействия между веществами.
Нужна помощь в написании работы?
Мы — биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
По периодической системе элементов
Самый простой способ — посмотреть в периодической системе элементов Менделеева. В ней для каждого элемента указан порядковый номер — это и есть заряд ядра, выраженный в единицах элементарного положительного заряда. Например, у водорода номер 1, значит в его ядре 1 протон, у углерода номер 6 — в ядре 6 протонов.

По числу протонов
Можно определить заряд ядра, если известно точное количество протонов в нем. Каждый протон имеет заряд +1. Поэтому, умножив это число на +1, мы получим величину положительного заряда ядра.
Например, в ядре азота 7 протонов. Значит, заряд его ядра равен 7 * (+1) = +7 .
Связь заряда ядра и порядкового номера элемента
В периодической системе химических элементов каждому элементу присвоен порядковый номер. Этот номер показывает количество протонов в ядре атома данного элемента. Поэтому заряд ядра элемента всегда численно равен его порядковому номеру.
Например, у натрия порядковый номер 11. Это означает, что в ядре атома натрия 11 протонов. Следовательно, заряд ядра натрия равен +11.
Заряд ядра химического элемента = Порядковый номер элемента в периодической системе
Значение заряда ядра
Заряд ядра имеет принципиальное значение для свойств атомов и образуемых ими веществ. Это связано с тем, что:
- Заряд ядра определяет количество электронов в атоме. Электроны формируют электронную оболочку и отвечают за химические свойства элемента.
- С увеличением заряда ядра усиливается притяжение между ядром и электронами, энергетические уровни электронов меняются.
- Чем больше заряд ядра, тем сильнее его взаимодействие с электронными оболочками других атомов при образовании химических связей.
Таким образом, зная заряд ядра элемента, можно предсказать основные закономерности изменения его свойств при движении по периодической системе.
Тесты по химии. Заряд ядра атома. А2 ЦТ 2012

Характеристики ядра
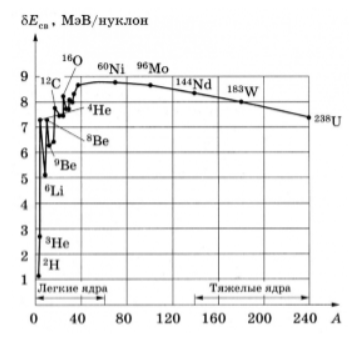
Основными характеристиками атомных ядер являются электрический заряд, масса, спин, энергия связи и так далее.
Ядро каждого из атомов обладает положительным зарядом. В качестве носителя положительного заряда выступает протон. По той причине, что заряд протона численно эквивалентен заряду электрона e , можно записать, что заряд ядра элемента равен + Z e ( Z выражает собой целое число, которое указывает на порядковый номер химического элемента в периодической системе химических элементов Д. И. Менделеева). Значение Z также характеризует число протонов, входящих в состав ядра и количество электронов в атоме. Именно из-за этого его определяют как атомный номер ядра. Электрический заряд представляет собой одну из основных характеристик атомного ядра, от которой зависят оптические, химические и иные свойства атомов.
Масса ядра
Существует также другая значимая характеристика ядра, а именно масса. Массу атомов и ядер принято выражать в атомных единицах массы (а.е.м.), в качестве атомной единицы массы выступает 1 12 массы нуклида углерода C 6 12 :
где N A = 6 , 022 · 10 23 м о л ь — 1 обозначает число Авогадро.
Кроме того, есть другой способ выражения атомной массы: исходя из соотношения Эйнштейна E = m c 2 , ее выражают в единицах энергии. По той причине, что масса протона m p = 1 . 00728 а . е . м . = 938 , 28 М э В , масса нейтрона m n = 1 . 00866 а . е . м . = 939 , 57 М э В , а масса электрона m e = 5 , 49 ⋅ 10 — 4 а . е . м . = 0 , 511 М э В ,
Из приведенных выше значений видно, что масса электрона несущественно мала, если сравнивать ее с массой ядра, поэтому масса ядра практически эквивалентна массе всего атома и отлична от целых чисел.
Фактчек
- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.
Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
Проверьте свои знания
1. Какие элементарные частицы составляют ядро атома? Как определить заряд ядра атома, количество протонов в ядре, количество нейтронов, массовое число элемента?
Ядро атома образовано элементарными частицами двух видов: протонами и нейтронами.
Заряд ядра атома численно равен количеству протонов.
Число протонов в ядре равно числу электронов в электронной оболочке.
Количество нейтронов можно рассчитать по формуле: массовое число − количество протонов.
Масса ядра атома численно равна сумме протонов и нейтронов. Эту величину называют массовым числом атома.
2. Сравните между собой элементарные частицы, т. е. найдите общее и различия между протоном и нейтроном, протоном и электроном.
Сравним между собой элементарные частицы.
Протон:
1) Масса: 1,67 * $10^$ кг.
2) Заряд: +1.
3) Число протонов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева
Нейтрон:
1) Масса: 1,67 * $10^$ кг.
2) Заряд: 0.
3) Число нейтронов в атоме находят по формуле N = A – Z, где A − это массовое число, Z − количество протонов.
Электрон:
1) Масса: 9,11 * $10^$ кг.
2) Заряд: −1.
3) Число электронов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева.
3. Что называют изотопами? Запишите обозначения изотопов водорода, хлора и калия.
Атомы одного химического элемента, содержащие различное число нейтронов в ядре и, следовательно, имеющие различные массовые числа, называются изотопами.
$^_$Cl, $^_$Cl − обозначение изотопов хлора.
$^_$H, $^_$H, $^_ $H − обозначение изотопов водорода.
$^_ $K, $^_$K − обозначение изотопов калия.
Примените свои знания
4. Рассчитайте число нейтронов в ядрах атомов: $^$N, $^$F, $^$Al, $^$Cl, $^$Ag.
Посчитаем количество нейтронов по формуле: A = Z + N, где Z − массовое число, N − количество протонов.
Значение N и Z можно узнать по таблице Д. И. Менделеева.
$^$N: 15 − 7 = 8
$^$F: 19 − 9 = 10
$^$Al: 27 − 13 = 14
$^$Cl: 37 − 17 = 20
$^$Ag: 108 − 47 = 61
5. Вместо символа «X» запишите соответствующее число или символ химического элемента: $^_$Mg, $^_$X,
Проверьте свои знания
1. Какие элементарные частицы составляют ядро атома? Как определить заряд ядра атома, количество протонов в ядре, количество нейтронов, массовое число элемента?
Ядро атома образовано элементарными частицами двух видов: протонами и нейтронами.
Заряд ядра атома численно равен количеству протонов.
Число протонов в ядре равно числу электронов в электронной оболочке.
Количество нейтронов можно рассчитать по формуле: массовое число − количество протонов.
Масса ядра атома численно равна сумме протонов и нейтронов. Эту величину называют массовым числом атома.
2. Сравните между собой элементарные частицы, т. е. найдите общее и различия между протоном и нейтроном, протоном и электроном.
Сравним между собой элементарные частицы.
Протон:
1) Масса: 1,67 * $10^$ кг.
2) Заряд: +1.
3) Число протонов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева
Нейтрон:
1) Масса: 1,67 * $10^$ кг.
2) Заряд: 0.
3) Число нейтронов в атоме находят по формуле N = A – Z, где A − это массовое число, Z − количество протонов.
Электрон:
1) Масса: 9,11 * $10^$ кг.
2) Заряд: −1.
3) Число электронов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева.
3. Что называют изотопами? Запишите обозначения изотопов водорода, хлора и калия.
Атомы одного химического элемента, содержащие различное число нейтронов в ядре и, следовательно, имеющие различные массовые числа, называются изотопами.
$^_$Cl, $^_$Cl − обозначение изотопов хлора.
$^_$H, $^_$H, $^_ $H − обозначение изотопов водорода.
$^_ $K, $^_$K − обозначение изотопов калия.
Используйте дополнительную информацию
9. Подготовьте сообщение и презентацию на тему «Эволюция представлений о сложном строении атома».
Эволюция представлений о сложном строении атома
Модели атомов:
1) Кусочки материи − Демокрит полагал, что свойства того или иного вещества определяются формой, массой и другими характеристиками образующих его атомов.
2) Модель атома Томпсона (модель «Пудинг с изюмом»). Томпсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами.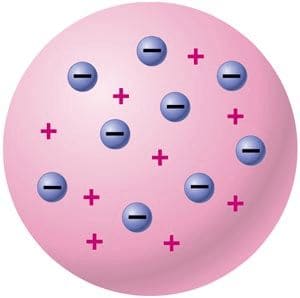
3) Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн: вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца.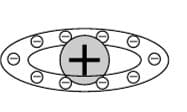
4) Планетарная модель атома Бора−Резерфорда. В 1911 году Эрнест Резерфорд пришёл к выводу, что атом представляет собой подобие планетарной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора−Резерфорда»).
5) Квантово−механическая модель атома. Ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько−нибудь определённым траекториям (неопределенность координаты электрона в атоме может быть сравнима с размерами самого атома).
- Вы здесь:
- 8 класс
- Химия
- ГДЗ ответы к учебнику химия 8 класс, Габриелян, Остроумов, Сладков
$K,
Проверьте свои знания
1. Какие элементарные частицы составляют ядро атома? Как определить заряд ядра атома, количество протонов в ядре, количество нейтронов, массовое число элемента?
Ядро атома образовано элементарными частицами двух видов: протонами и нейтронами.
Заряд ядра атома численно равен количеству протонов.
Число протонов в ядре равно числу электронов в электронной оболочке.
Количество нейтронов можно рассчитать по формуле: массовое число − количество протонов.
Масса ядра атома численно равна сумме протонов и нейтронов. Эту величину называют массовым числом атома.
2. Сравните между собой элементарные частицы, т. е. найдите общее и различия между протоном и нейтроном, протоном и электроном.
Сравним между собой элементарные частицы.
Протон:
1) Масса: 1,67 * $10^$ кг.
2) Заряд: +1.
3) Число протонов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева
Нейтрон:
1) Масса: 1,67 * $10^$ кг.
2) Заряд: 0.
3) Число нейтронов в атоме находят по формуле N = A – Z, где A − это массовое число, Z − количество протонов.
Электрон:
1) Масса: 9,11 * $10^$ кг.
2) Заряд: −1.
3) Число электронов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева.
3. Что называют изотопами? Запишите обозначения изотопов водорода, хлора и калия.
Атомы одного химического элемента, содержащие различное число нейтронов в ядре и, следовательно, имеющие различные массовые числа, называются изотопами.
$^_$Cl, $^_$Cl − обозначение изотопов хлора.
$^_$H, $^_$H, $^_ $H − обозначение изотопов водорода.
$^_ $K, $^_$K − обозначение изотопов калия.
$X.
$^_ $Mg: X − это количество протонов, или порядковый номер, это значение можно узнать по таблице Менделеева.
Ответ: X = 12.
$^_ $X: нам известно массовое число и количество протонов, то есть порядковый номер элемента, элемент можем узнать по таблице Менделеева.
Ответ: X − хром (Cr).
Проверьте свои знания
1. Какие элементарные частицы составляют ядро атома? Как определить заряд ядра атома, количество протонов в ядре, количество нейтронов, массовое число элемента?
Ядро атома образовано элементарными частицами двух видов: протонами и нейтронами.
Заряд ядра атома численно равен количеству протонов.
Число протонов в ядре равно числу электронов в электронной оболочке.
Количество нейтронов можно рассчитать по формуле: массовое число − количество протонов.
Масса ядра атома численно равна сумме протонов и нейтронов. Эту величину называют массовым числом атома.
2. Сравните между собой элементарные частицы, т. е. найдите общее и различия между протоном и нейтроном, протоном и электроном.
Сравним между собой элементарные частицы.
Протон:
1) Масса: 1,67 * $10^$ кг.
2) Заряд: +1.
3) Число протонов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева
Нейтрон:
1) Масса: 1,67 * $10^$ кг.
2) Заряд: 0.
3) Число нейтронов в атоме находят по формуле N = A – Z, где A − это массовое число, Z − количество протонов.
Электрон:
1) Масса: 9,11 * $10^$ кг.
2) Заряд: −1.
3) Число электронов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева.
3. Что называют изотопами? Запишите обозначения изотопов водорода, хлора и калия.
Атомы одного химического элемента, содержащие различное число нейтронов в ядре и, следовательно, имеющие различные массовые числа, называются изотопами.
$^_$Cl, $^_$Cl − обозначение изотопов хлора.
$^_$H, $^_$H, $^_ $H − обозначение изотопов водорода.
$^_ $K, $^_$K − обозначение изотопов калия.
$K: X − это количество протонов, или порядковый номер, это значение можно узнать по таблице Менделеева.
Ответ: X = 19.
Проверьте свои знания
1. Какие элементарные частицы составляют ядро атома? Как определить заряд ядра атома, количество протонов в ядре, количество нейтронов, массовое число элемента?
Ядро атома образовано элементарными частицами двух видов: протонами и нейтронами.
Заряд ядра атома численно равен количеству протонов.
Число протонов в ядре равно числу электронов в электронной оболочке.
Количество нейтронов можно рассчитать по формуле: массовое число − количество протонов.
Масса ядра атома численно равна сумме протонов и нейтронов. Эту величину называют массовым числом атома.
2. Сравните между собой элементарные частицы, т. е. найдите общее и различия между протоном и нейтроном, протоном и электроном.
Сравним между собой элементарные частицы.
Протон:
1) Масса: 1,67 * $10^$ кг.
2) Заряд: +1.
3) Число протонов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева
Нейтрон:
1) Масса: 1,67 * $10^$ кг.
2) Заряд: 0.
3) Число нейтронов в атоме находят по формуле N = A – Z, где A − это массовое число, Z − количество протонов.
Электрон:
1) Масса: 9,11 * $10^$ кг.
2) Заряд: −1.
3) Число электронов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева.
3. Что называют изотопами? Запишите обозначения изотопов водорода, хлора и калия.
Атомы одного химического элемента, содержащие различное число нейтронов в ядре и, следовательно, имеющие различные массовые числа, называются изотопами.
$^_$Cl, $^_$Cl − обозначение изотопов хлора.
$^_$H, $^_$H, $^_ $H − обозначение изотопов водорода.
$^_ $K, $^_$K − обозначение изотопов калия.
$X: нам известно количество протонов, то есть порядковый номер элемента, элемент можем узнать по таблице Менделеева.
Ответ: X − кремний (Si).
6. Определите, сколько различных молекул хлороводорода можно составить из природного изотопа водорода
$^_ $H и двух природных изотопов хлора − $^_ $Cl и $^_$Cl. Рассчитайте их относительные молекулярные массы.
Дано:
$^_ $H,
$^_$Cl,
$^_$Cl
Найти:
Mr − ?
Решение:
$^_ $H + $^_$Cl = HCl
Mr = 1 + 35 = 36
$^_$H + $^_$Cl = HCl
Mr = 1 + 37 = 38
Ответ: можно составить 2 молекулы хлороводорода.
7. Относительная атомная масса брома, приведённая в таблице Д. И. Менделеева, равна 80. Однако изотопа с таким массовым числом не существует. В природе бром представлен изотопами $^$Br и $^$Br. Рассчитайте число нейтронов в ядрах этих изотопов.
Рассчитаем число нейтронов в ядрах этих изотопов по формуле: N = A − Z, где A − массовое число; Z − количество протонов.
По таблице Менделеева узнаем, что Z = 35.
$^$Br: 79 − 35 = 44
$^$Br: 81 − 35 = 46
8. Определите количество протонов, нейтронов и электронов в атомах следующих изотопов: а) $^_S$; б) $^_B$; в) $^_C$; г) $^_Br$; д) $^_H$
а) Количество нейтронов рассчитывается по формуле: N = A − Z, где N − количество нейтронов, A − массовое число; Z − количество протонов.
Количество протонов равняется количеству электронов и порядковому номеру.
$^_S$
N = 34 − 16 = 18
Z = e = 16
б) Количество нейтронов рассчитывается по формуле: N = A − Z, где N − количество нейтронов, A − массовое число; Z − количество протонов.
Количество протонов равняется количеству электронов и порядковому номеру.
$^_B$
N = 11 − 5 = 6
Z = e = 5
в) Количество нейтронов рассчитывается по формуле: N = A − Z, где N − количество нейтронов, A − массовое число; Z − количество протонов.
Количество протонов равняется количеству электронов и порядковому номеру.
$^_C$
N = 13 − 6 = 7
Z = e = 6
г) Количество нейтронов рассчитывается по формуле: N = A − Z, где N − количество нейтронов, A − массовое число; Z − количество протонов.
Количество протонов равняется количеству электронов и порядковому номеру.
$^_Br$
N = 79 − 35 = 44
Z = e = 35
д) Количество нейтронов рассчитывается по формуле: N = A − Z, где N − количество нейтронов, A − массовое число; Z − количество протонов.
Количество протонов равняется количеству электронов и порядковому номеру.
$^_H$
N = 3 − 1 = 2
Z = e = 1
Главные правила образования оболочки электронов в атоме

Источник
Давайте дадим волю фантазии, допустим, к нашему семиэтажному дому подошёл Бор, не лес как вы могли подумать, а элемент. Смотрим в шпаргалку, как вы уже догадались, это будет периодическая таблица, и ищем там его расположение. Бор занимает ячейку под номером 5. Эта ячейка находится во втором периоде, третьей группе. Значит, число электронов в атоме 5, они размещаются на I и II этажах. Первый уровень будут занимать 2 электрона. Значит на второй этаж (внешний уровень) переходят оставшиеся 3. Два будут занимать s-подуровень, один будет размещаться на р-подуровне. Строение оболочки атома В (бор).
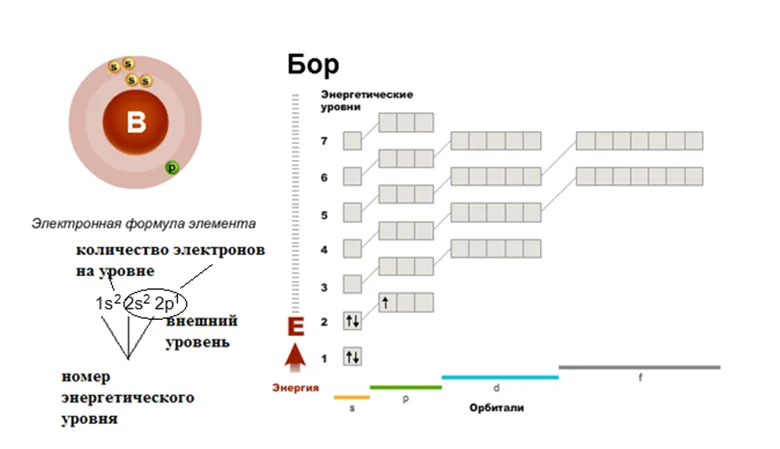
Составим электронную и графическую схему элемента на примере Si и V с помощью алгоритма.

Обратите внимание, чтобы составить электронную формулу элемента, достаточно знать его расположение в ПСХЭ. Итак, начинаем по порядку.
- Кремний, находится под № 14, символ Si.Ar (Si) = 28
- Заряд ядра +14. e = 14, р = 14, n = 28 – 14 = 14
- III период, IV (А)группа.
- Энергетических уровней 3. Не забываем, что следуя правилу Гунда, электроны занимают, ячейку по одному на внешнем p-подуровне
- Исходя с этого всего, электронная оболочка атома записывается в виде формулы

- Ванадий, № 23, символ V.
- Заряд ядра +23. Электронов 23.
- IV период, V(Б) группе.
- Энергетических уровней 4. IV открывает большие периоды, которые имеют свою особенность заполнения. Применив принцип Клечковского, мы увидим, что изначально заполняется 4s-подуровень, а только тогда 3d-подуровень.
- Исходя с этого всего, схема строения электронной оболочки атома запишется в следующем виде.

Существует основное состояние электрона в атоме и возбуждённое, которое возникает, если к атому применить некоторую определённую энергию. Электроны во внешнем электронном слое атома имеют способность перемещаться, занимая место на свободной орбитали, образуя при этом возбуждённое состояние.

Обратите внимание, число неспаренных электронов отвечает валентности элементов: Li (I), Be (II), B (III), C (II и IV).
Периодичность свойств элементов. Электроотрицательность
С развитием учения о строении атома, периодический закон занимает ещё больше значимое место в естествознании. Уже неоднократно говорилось, что ПСХЭ является уникальной подсказкой. Достаточно знать расположение и строение электронных оболочек атомов элементов, и возникает возможность судить о том, какими характеристиками он будет обладать. В настоящее время периодический закон имеет формулировку, данную Менделеевым, с небольшим уточнением.

За то, какими свойствами будет наделён элемент, отвечают электроны, которые размещены на внешнем энергетическом уровне. Их ещё называют валентные электроны атома, именно они отвечают за периодическое изменение свойств элементов.
С увеличением массы атома в пределах периода, количество электронов также возрастает, пока не заполнятся все вакантные ячейки уровня.
В ходе химической реакции происходит «движение» электронов. Т.е. одни элементы будут отдавать их, а вторые принимать.
Электроотрицательность — это способность атома «оттягивать» на себя электронную плотность других атомов
При образовании химических связей, каждый атом стремится «к совершенству», т.е. завершить энергетический уровень. Такой уровень имеют благородные газы ns 2 np 6 . А остальным чтобы получить данную конфигурацию необходимо отдать, либо принять электроны.
Рассмотрим на примере, образования вещества NaCl.

Отдав свой один электрон с внешнего 3s-уровня, атом Натрия образует ион Na + , по своей электронной конфигурации аналогичный Неону. Хлор принимая электрон, образует ион Cl − – принимая электронную конфигурацию Аргона.
Обобщая данный пример, сделаем вывод, элементы, которые содержат малое количество электронов на внешнем уровне (1 – 3) будут только отдавать электроны – и они будут относиться к металлам. Неметаллы характеризуются способностью принимать электроны.

Из определения сделаем вывод, что наибольшую электроотрицательность имеет Фтор (F), нет ни одного элемента, кому бы он смог отдать свой электрон, а будет только забирать. Минимальную ЭО будет иметь Франций (Fr).
Ещё одна важная причина изменения свойств элементов, которая изменяется периодически, это радиус атома. Если ЭО характеризует неметаллы, то по радиусу судят о металлических свойствах. Металлы легко отдают электроны, чем дальше они находятся от ядра, тем легче «отрываются». Радиус атома с увеличением заряда ядра в периоде уменьшается, так как ядро начинает сильнее притягивать электроны.