В центре каждого атома находится ядро, крохотный набор частиц под названием протоны и нейтроны. В этой статье мы изучим природу протонов и нейтронов, состоящих из частиц ещё мельче размером – кварков, глюонов и антикварков. (Глюоны, как и фотоны, являются античастицами сами себе). Кварки и глюоны, насколько нам известно, могут быть по-настоящему элементарными (неделимыми и не состоящими из чего-то мельче размером). Но к ним позже.
Как ни удивительно, у протонов и нейтронов масса почти одинаковая – с точностью до процента:
- 0,93827 ГэВ/с 2 у протона,
- 0,93957 ГэВ/с 2 у нейтрона.
Поскольку они так похожи, и поскольку из этих частиц состоят ядра, протоны и нейтроны часто называют нуклонами.
Протоны идентифицировали и описали примерно в 1920 году (хотя открыты они были раньше; ядро атома водорода – это просто отдельный протон), а нейтроны нашли где-то в 1933-м. То, что протоны и нейтроны так похожи друг на друга, поняли почти сразу. Но то, что у них есть измеримый размер, сравнимый с размером ядра (примерно в 100 000 раз меньше атома по радиусу), не знали до 1954-го. То, что они состоит из кварков, антикварков и глюонов, постепенно понимали с середины 1960-х до середины 1970-х. К концу 70-х и началу 80-х наше понимание протонов, нейтронов, и того, из чего они состоят, по большей части устаканилось, и с тех пор остаётся неизменным.
Нуклоны описать гораздо труднее, чем атомы или ядра. Не сказать, что атомы в принципе простые, но по крайней мере, можно сказать, не раздумывая, что атом гелия состоит из двух электронов, находящихся на орбите вокруг крохотного ядра гелия; а ядро гелия – достаточно простая группа из двух нейтронов и двух протонов. А вот с нуклонами всё уже не так просто. Я уже писал в статье «Что такое протон, и что у него внутри?», что атом похож на элегантный менуэт, а нуклон – на дикую вечеринку.
Сложность протона и нейтрона, судя по всему, всамделишные, и не проистекают из неполных физических знаний. У нас есть уравнения, используемые для описания кварков, антикварков и глюонов, а также сильных ядерных взаимодействий, происходящих между ними. Эти уравнения называются КХД, от «квантовая хромодинамика». Точность уравнений можно проверять различными способами, включая измерение количества появляющихся на Большом адронном коллайдере частиц. Подставляя уравнения КХД в компьютер и запуская вычисления свойств протонов и нейтронов, и других сходных частиц (с общим названием «адроны»), мы получаем предсказания свойств этих частиц, хорошо приближающиеся к наблюдениям, сделанным в реальном мире. Поэтому у нас есть основания полагать, что уравнения КХД не врут, и что наше знание протона и нейтрона основано на верных уравнениях. Но просто иметь правильные уравнения недостаточно, ибо:
- У простых уравнений могут оказаться очень сложные решения,
- Иногда невозможно описать сложные решения простым способом.
Из-за внутренней сложности нуклонов вам, читатель, придётся сделать выбор: как много вы хотите узнать по поводу описанной сложности? Неважно, как далеко вы зайдёте, удовлетворения это вам, скорее всего, не принесёт: чем больше вы будете узнавать, тем понятнее вам будет становиться тема, но итоговый ответ останется тем же – протон и нейтрон очень сложны. Я могу предложить вам три уровня понимания, с увеличением детализации; вы же можете остановиться после любого уровня и перейти на другие темы, или можете погружаться до последнего. По поводу каждого уровня возникают вопросы, ответы на которые я могу частично дать в следующем, но новые ответы вызывают новые вопросы. В итоге – как я делаю в профессиональных обсуждениях с коллегами и продвинутыми студентами – я могу лишь отослать вас к данным полученным в реальных экспериментах, к различным влиятельным теоретическим аргументам, и компьютерным симуляциям.
Первый уровень понимания
Из чего состоят протоны и нейтроны?
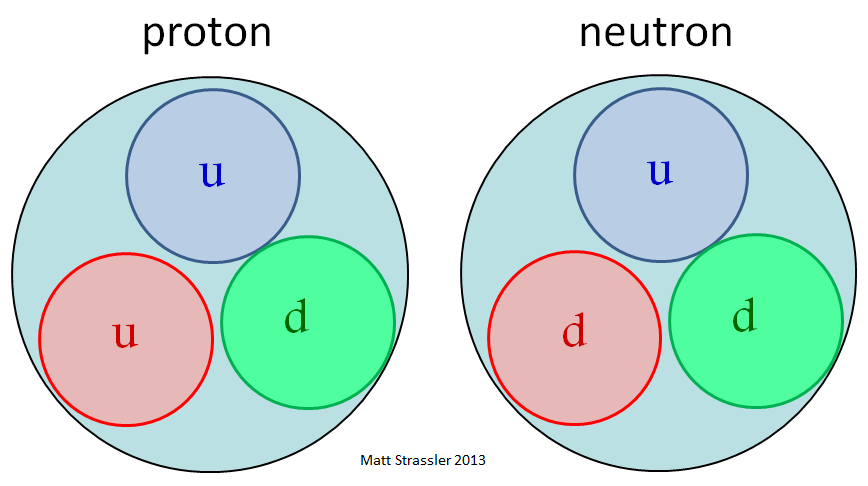
Рис. 1: чрезмерно упрощённая версия протонов, состоящих только из двух верхних кварков и одного нижнего, и нейтронов, состоящих только из двух нижних кварков и одного верхнего
Чтобы упростить дело, во многих книгах, статьях и на сайтах указано, что протоны состоят из трёх кварков (двух верхних и одно нижнего) и рисуют нечто вроде рис. 1. Нейтрон такой же, только состоящий из одного верхнего и двух нижних кварков. Это простое изображение иллюстрирует то, во что верили некоторые учёные, в основном в 1960-х. Но вскоре стало понятно, что эта точка зрения чрезмерно упрощена до такой степени, что уже не является корректной.
Из более искушённых источников информации вы узнаете, что протоны состоит из трёх кварков (двух верхних и одного нижнего), удерживаемых вместе глюонами – и там может появиться картинка, похожая на рис. 2, где глюоны нарисованы в виде пружинок или ниток, удерживающих кварки. Нейтроны такие же, только с одним верхним кварком и двумя нижними.
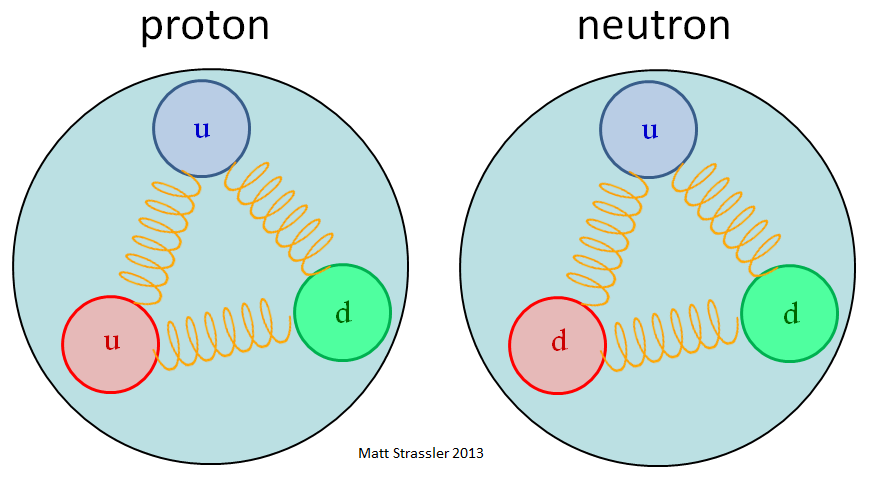
Рис. 2: улучшение рис. 1 за счёт акцента на важной роли сильного ядерного взаимодействия, удерживающего кварки в протоне
Не такой уж плохой способ описания нуклонов, поскольку он делает акцент на важной роли сильного ядерного взаимодействия, удерживающего кварки в протоне за счёт глюонов (точно так же, как с электромагнитным взаимодействием связан фотон, частица, из которых состоит свет). Но это тоже сбивает с толку, поскольку на самом деле не объясняет, что такое глюоны и что они делают.
Есть причины двигаться дальше и описывать вещи так, как я делал в других статьях: протон состоит из трёх кварков (двух верхних и одного нижнего), кучи глюонов и горы пар кварк-антикварк (в основном это верхние и нижние кварки, но есть и несколько странных). Все они летают туда и сюда с очень большой скоростью (приближаясь к скорости света); весь этот набор удерживается при помощи сильного ядерного взаимодействия. Я продемонстрировал это на рис. 3. Нейтроны опять такие же, но с одним верхним и двумя нижними кварками; изменивший принадлежность кварк указан стрелкой.
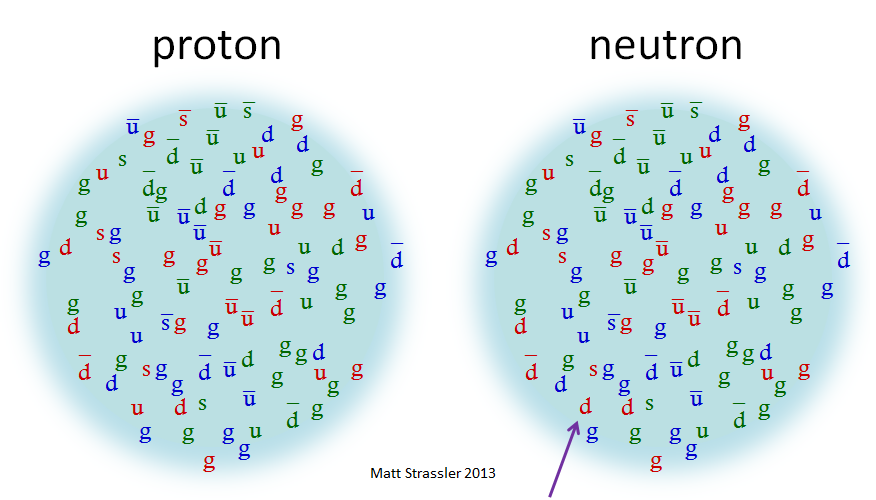
Рис. 3: более реалистичное, хотя всё равно неидеальное изображение протонов и нейтронов
Эти кварки, антикварки и глюоны не только бешено носятся туда-сюда, но и сталкиваются друг с другом, и превращаются друг в друга через такие процессы, как аннигиляция частиц (в которой кварк и антикварк одного типа превращаются в два глюона, или наоборот) или поглощение и испускание глюона (в котором могут столкнуться кварк и глюон и породить кварк и два глюона, или наоборот).
Что у этих трёх описаний общего:
- Два верхних кварка и нижний кварк (плюс что-то ещё) у протона.
- Один верхний кварк и два нижних кварка (плюс ещё что-то) у нейтрона.
- «Ещё что-то» у нейтронов совпадает с «ещё чем-то» у протонов. То есть, у нуклонов «ещё что-то» одинаковое.
- Небольшая разница в массе у протона и нейтрона появляется из-за разницы масс нижнего кварка и верхнего кварка.
- у верхних кварков электрический заряд равен 2/3 e (где e – заряд протона, -e – заряд электрона),
- у нижних кварков заряд равен -1/3e,
- у глюонов заряд 0,
- у любого кварка и соответствующего ему антикварка общий заряд равен 0 (к примеру, у антинижнего кварка заряд +1/3e, так что у нижнего кварка и нижнего антикварка заряд будет –1/3 e +1/3 e = 0),
- общий электрический заряд протона 2/3 e + 2/3 e – 1/3 e = e,
- общий электрический заряд нейтрона 2/3 e – 1/3 e – 1/3 e = 0.
- сколько «ещё чего-то» внутри нуклона,
- что оно там делает,
- откуда берутся масса и энергия массы (E = mc 2 , энергия, присутствующая там, даже когда частица покоится) нуклона.
Рис. 1 говорит о том, что кварки, по сути, представляют собой треть нуклона – примерно так, как протон или нейтрон представляют четверть ядра гелия или 1/12 ядра углерода. Если бы этот рисунок был правдив, кварки в нуклоне двигались бы относительно медленно (со скоростями гораздо меньшими световой) с относительно слабыми взаимодействиями, действующими между ними (хотя и при наличии некоей мощной силы, удерживающей их на месте). Масса кварка, верхнего и нижнего, составляла бы тогда порядка 0,3 ГэВ/с 2 , примерно треть массы протона. Но это простое изображение и навязываемые им идеи просто неверны.
Рис. 3. даёт совершенно другое представление о протоне, как о котле частиц, снующих в нём со скоростями, близкими к световой. Эти частицы сталкиваются друг с другом, и в этих столкновениях некоторые из них аннигилируют, а другие создаются на их месте. Глюоны не имеют массы, массы верхних кварков составляют порядка 0,004 ГэВ/с 2 , а нижних – порядка 0,008 ГэВ/с 2 — в сотни раз меньше протона. Откуда берётся энергия массы протона, вопрос сложный: часть её идёт от энергии массы кварков и антикварков, часть – от энергии движения кварков, антикварков и глюонов, а часть (возможно, положительная, возможно, отрицательная) из энергии, хранящейся в сильном ядерном взаимодействии, удерживающем кварки, антикварки и глюоны вместе.
В некотором смысле рис. 2 пытается устранить разницу между рис. 1 и рис. 3. Он упрощает рис. 3, удаляя множество пар кварк-антикварк, которые, в принципе, можно назвать эфемерными, поскольку они постоянно возникают и исчезают, и не являются необходимыми. Но она производит впечатление того, что глюоны в нуклонах являются непосредственной частью сильного ядерного взаимодействия, удерживающего протоны. И она не объясняет, откуда берётся масса протона.
У рис. 1 есть другой недостаток, кроме узких рамок протона и нейтрона. Она не объясняет некоторые свойства других адронов, к примеру, пиона и ро-мезона. Те же проблемы есть и у рис. 2.
Эти ограничения и привели к тому, что своим студентам и на моём сайте, я даю картинку с рис. 3. Но хочу предупредить, что и у неё есть множество ограничений, которые я рассмотрю позже.
Стоит отметить, что чрезвычайную сложность строения, подразумеваемая рис. 3, стоило ожидать от объекта, который удерживает вместе такая мощная сила, как сильное ядерное взаимодействие. И ещё одно: три кварка (два верхних и один нижний у протона), не являющиеся частью группы пар кварков-антикварков, часто называют «валентными кварками», а пары кварков-антикварков – «морем кварковых пар». Такой язык во многих случаях технически удобен. Но он даёт ложное впечатление того, что если бы вы смогли заглянуть внутрь протона, и посмотрели на определённый кварк, вы сразу смогли бы сказать, является ли он частью моря или валентным. Этого сделать нельзя, такого способа просто нет.
Характеристика элементарных частиц
Из таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
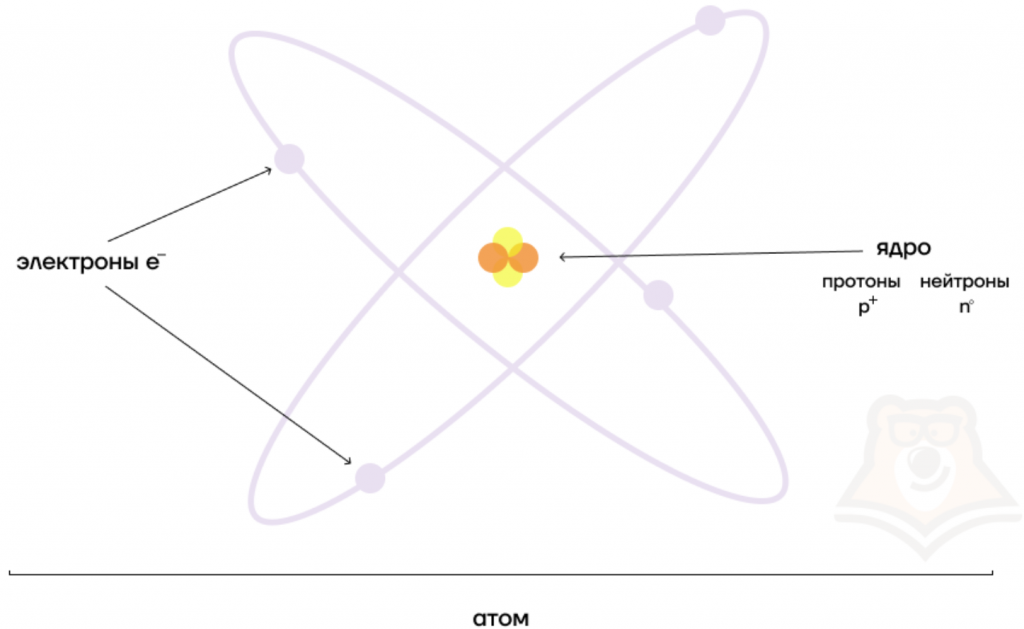
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.

Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
(№ элемента = p = Z = ē)
Число нейтронов = массовое число – порядковый номер
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями). Нумерация слоев начинается с ближайшего к ядру электронного слоя.
- На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.
- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.

На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атом
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.

Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
Масса протона и масса нейтрона
Поскольку массы протона и нейтрона так похожи, и поскольку протон и нейтрон отличаются только заменой верхнего кварка нижним, кажется вероятным, что их массы обеспечиваются одним и тем же способом, исходят из одного источника, и их разница заключается в небольшом отличии между верхним и нижним кварками. Но три приведённых рисунка говорят о наличии трёх очень разных взглядов на происхождение массы протона.
Рис. 1 говорит о том, что верхний и нижний кварки просто составляют по 1/3 от массы протона и нейтрона: порядка 0,313 ГэВ/с 2 , или из-за энергии, необходимой для удержания кварков в протоне. И поскольку разница между массами протона и нейтрона составляет долю процента, разница между массами верхнего и нижнего кварка тоже должна составлять долю процента.
Рис. 2 менее понятен. Какая часть массы протона существует благодаря глюонам? Но, в принципе, из рисунка следует, что большая часть массы протона всё равно происходит от массы кварков, как на рис. 1.
Рис. 3 отражает более тонкий подход к тому, как на самом деле появляется масса протона (как мы можем проверить напрямую через компьютерные вычисления протона, и не напрямую с использованием других математических методов). Он сильно отличается от идей, представленных на рис. 1 и 2, и оказывается не таким простым.
Чтобы понять, как это работает, нужно думать не в терминах массы m протона, но в терминах его энергии массы E = mc 2 , энергии, связанной с массой. Концептуально правильным вопросом будет не «откуда взялась масса протона m», после которого вы можете подсчитать E, умножив m на c 2 , а наоборот: «откуда берётся энергия массы протона E», после которого можно подсчитать массу m, разделив E на c 2 .
Полезно классифицировать взносы в энергию массы протона по трём группам:
А) Энергия массы (энергия покоя) содержащихся в нём кварков и антикварков (глюоны, безмассовые частицы, никакого вклада не делают).
Б) Энергия движения (кинетическая энергия) кварков, антикварков и глюонов.
В) Энергия взаимодействия (энергия связи или потенциальная энергия), хранящаяся в сильном ядерном взаимодействии (точнее, в глюонных полях), удерживающих протон.
Рис. 3 говорит о том, что частицы внутри протона двигаются с большой скоростью, и что в нём полно безмассовых глюонов, поэтому вклад Б) больше А). Обычно, в большинстве физических систем Б) и В) оказываются сравнимыми, при этом В) часто отрицательно. Так что энергия массы протона (и нейтрона) в основном получается из комбинации Б) и В), а А) вносит малую долю. Поэтому массы протона и нейтрона появляются в основном не из-за масс содержащихся в них частиц, а из-за энергий движения этих частиц и энергии их взаимодействия, связанной с глюонными полями, порождающими силы, удерживающие протон. В большинстве других знакомых нам систем баланс энергий распределён по-другому. К примеру, в атомах и в Солнечной системе доминирует А), а Б) и В) получаются гораздо меньше, и сравнимы по величине.
Подводя итоги, укажем, что:
- Рис. 1 предполагает, что энергия массы протона происходит из вклада А).
- Рис. 2 предполагает, что важны оба вклада А) и В), и немного своей доли вносит Б).
- Рис. 3 предполагает, что важны Б) и В), а вклад А) оказывается незначительным.
Если рис. 3 не врёт, массы кварка и антикварка очень малы. Какие они на самом деле? Масса верхнего кварка (как и антикварка) не превышает 0,005 ГэВ/с 2 , что гораздо меньше, чем 0,313 ГэВ/с 2 , который следует из рис. 1. (Массу верхнего кварка тяжело измерить, и это значение меняется из-за тонких эффектов, так что она может оказаться гораздо меньшей, чем 0,005 ГэВ/с 2 ). Масса нижнего кварка примерно на 0,004 ГэВ/с 2 больше массы верхнего. Это значит, что масса любого кварка или антикварка не превышает одного процента массы протона.
Обратите внимание, что это означает (противореча рис. 1), что отношение массы нижнего кварка к верхнему не приближается к единице! Масса нижнего кварка как минимум в два раза превышает массу верхнего. Причина того, что массы нейтрона и протона так похожи, не в том, что похожи массы верхнего и нижнего кварков, а в том, что массы верхнего и нижнего кварков очень малы – и разница между ними мала, по отношению к массам протона и нейтрона. Вспомните, что для превращения протона в нейтрон, вам нужно просто заменить один из его верхних кварков на нижний (рис. 3). Этой замены достаточно для того, чтобы сделать нейтрон немного тяжелее протона, и поменять его заряд с +е на 0.
Кстати, тот факт, что различные частицы внутри протона сталкиваются друг с другом, и постоянно появляются и исчезают, не влияет на обсуждаемые нами вещи – энергия сохраняется в любом столкновении. Энергия массы и энергия движения кварков и глюонов может меняться, как и энергия их взаимодействия, но общая энергия протона не меняется, хотя всё внутри него постоянно меняется. Так что масса протона остаётся постоянной, несмотря на его внутренний вихрь.
На этом моменте можно остановиться и впитать полученную информацию. Поразительно! Практически вся масса, содержащаяся в обычной материи, происходит из массы нуклонов в атомах. И большая часть этой массы происходит из хаоса, присущего протону и нейтрону – из энергии движения кварков, глюонов и антикварков в нуклонах, и из энергии работы сильных ядерных взаимодействий, удерживающих нуклон в целом состоянии. Да: наша планета, наши тела, наше дыхание являются результатом такого тихого, и, до недавнего времени, невообразимого столпотворения.
- Научно-популярное
- Физика
Атомы
Атом — это мельчайшая химически неделимая частица вещества, а также наименьшая часть химического элемента, являющаяся носителем его свойств. Химически неделимая означает, что атом в ходе химических реакций не делится на более мелкие части.
Атомы очень маленькие частицы, их размер находится в диапазоне от одного до пяти ангстрем (обозначается — Å.). Один ангстрем — это 10 –10 метра.
Состав и строение атомов
Атомы состоят из ещё более мелких частиц.
В центре любого атома находится положительно заряженное ядро. В пространстве вокруг ядра находятся отрицательно заряженные частицы — электроны, которые образуют так называемое электронное облако . Таким образом, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Пример. Атом гелия состоит из ядра, в котором находятся два протона и два нейтрона, и двух электронов:

Ядро атома — это центральная часть атома, в которой сосредоточена основная его масса и весь положительный электрический заряд. Ядро атома состоит из протонов и нейтронов.
Протон — это частица, которая имеет положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона — p + .
Нейтрон — это частица, не имеющая электрического заряда. Заряд нейтрона равен 0. Символ нейтрона — n 0 .
Протоны и нейтроны имеют общее название — нуклоны.
Ядра атомов имеют положительный заряд, так как состоят из протонов с положительным зарядом и нейтронов. По величине заряд равен количеству протонов в ядре и совпадает с порядковым номером элемента в периодической системе.
Электрон — это частица, которая имеет отрицательный электрический заряд. Заряд электрона в условных единицах равен -1. Символ электрона — e .
Протоны, нейтроны и электроны имеют общее название — элементарные частицы или субатомные частицы.
| Протон | p + | +1 |
| Нейтрон | n 0 | 0 |
| Электрон | e | -1 |
Заряд протона и электрона одинаковы по величине, но противоположны по знаку. Любой атом содержит равное число протонов и электронов, значит заряд ядра и суммарный заряд всех электронов атома одинаковы по величине, но противоположны по знаку. Следовательно, атомы являются электронейтральными частицами.
Другие способы определения числа частиц
Кроме использования таблицы Менделеева, существуют и другие способы — как определить количество электронов и других субатомных частиц:
- С помощью спектрального анализа по спектру испускания или поглощения.
- При помощи рентгеноструктурного анализа.
- С использованием масс-спектрометрии, определяющей соотношение массы и заряда частиц.
Однако в большинстве случаев используется простой и наглядный способ определения числа протонов, нейтронов и электронов по таблице Менделеева, описанный вначале.
Электронные конфигурации атомов и ионов
Помимо определения общего числа электронов в атоме, важно также знать, как эти электроны распределены по электронным слоям и орбиталям. Это распределение называется электронной конфигурацией и записывается в виде:
Здесь цифры перед буквами обозначают номер электронного слоя (1, 2, 3. ), буквы s, p, d — тип орбитали, а цифры после букв — число электронов на данной орбитали. Чтобы построить электронную конфигурацию, нужно знать порядок заполнения орбиталей:
- 1s2;
- 2s, 2p6;
- 3s2, 3p6, 3d;
- 4s2, 4p, 4d и т.д.
Атом — его состав и структура
Атом — основная единица элементов. Состав атома и его строение определяет различные свойства элементов. Например, состав атома кристалла кремния будет отличаться от структуры, что представляет, например, вещество уран.
Слово «атом» происходит от греческих корней «а»(без) и «том» (вырезать) что означает «неделимый». Вплоть до 20-го века атомы считались минимально возможными частицами.
Ядро является центральным, очень плотным компонентом атома. Оно состоит из протонов и нейтронов (совместно называемых нуклонами) и отвечает за большую часть атомной массы. Протоны и нейтроны удерживаются вместе в ядре так называемым сильным ядерным взаимодействием (которое является самой сильной известной силой во Вселенной). Вокруг ядра находится облако гораздо меньших и более легких электронов, которые притягиваются к ядру электромагнитной силой от взаимодействия с протонами. Различные количества протонов, нейтронов и электронов приводят к тому, что атом обладает различными химическими свойствами, которые определяют, что это за элемент. Атомы невообразимо малы, а их ядра в 1000 раз меньше. На самом деле один кубический сантиметр кремния, содержит приблизительно 5 х 10 22 атома (это 5 с 22 нулями после него!). Это масштабы Вселенной, чтобы увидеть визуальное представление о том, насколько они малы.
Протоны
Протоны — это положительно заряженные частицы, которые находятся внутри ядра атома.
Элемент можно распознать по числу протонов в ядре одного из своих атомов. Кроме того, число протонов определяет место элемента в периодической таблице элементов. Например, состав атома углерода имеет ровно 6 протонов в своем ядре и, таким образом, номер 6 в периодической таблице элементов, торий имеет ровно 90 протонов и, таким образом, номер 90 в периодической таблице элементов.
Протоны отталкиваются друг от друга электромагнитной силой, но стягиваются вместе сильной силой, которая сильнее на коротких расстояниях (эти расстояния составляют около ферми или 10-15 м). Протоны очень маленькие, около 10-15 м в 10 000 раз меньше атома! Несмотря на свои невероятно малые размеры, протоны толкают друг друга с огромной силой, около 100 Н, сравнимой с весом маленькой собаки!
Заряд протона в точности равен и противоположен заряду электрона. Поэтому число электронов в нейтральном атоме всегда равно числу протонов. Протоны состоят из более мелких частиц, называемых кварками, которые также составляют нейтроны.
Число протонов в ядре называется атомным номером, и это число определяет, каким элементом является вещество. Другими словами, изменение числа протонов, изменяет элемент. Это число протонов (атомный номер) изменяется, когда ядро подвергается бета-распаду или альфа-распаду в любой из его различных форм.
Сложность намеренного изменения количества протонов в ядре велика. Вот почему алхимия (средневековая практика превращения свинца в золото) так долго терпит неудачу!
Нейтроны
Нейтроны имеют ту же массу, что и протоны, что делает их легко определяемыми, сколько находятся в составе ядра атома.
Простое вычитание числа протонов из атомной массы атома даст число нейтронов. Например, цезий является номером 55 в периодической таблице элементов и, следовательно, имеет 55 протонов; кроме того, его атомная масса (обычно также найденная в периодической таблице), как известно, составляет 133 (единицы атомной массы). Вычитание 55 из 133 дает 78, то есть число нейтронов в атоме. Один и тот же тип атома (определяемый количеством протонов) может иметь разное количество нейтронов. Они называются различными изотопами атома. Например, углерод-12 является одним изотопом углерода, а углерод-14 — другим изотопом углерода. Имеется общее название составляющих атомного ядра. Нуклон — частица из протона и нейтрона, которые образуют ядро. Нуклиды — совокупность атомов с определенным значением нейтронов и протонов: одинаковое число протонов, но разным числом нейтронов. Нуклоны и нуклиды разные понятия.
Электроны
Электроны — это отрицательно заряженные частицы, которые существуют в облаке вокруг ядра атома. Они невообразимо малы, настолько малы, что квантовая механика необходима для объяснения их специфического поведения, и насколько физика смогла определить, они являются фундаментальной частицей. Лучше всего представить электроны как крошечные частицы, которые» вращаются » вокруг ядра. Их радиус настолько мал, что никто не смог его обнаружить, но он невероятно круглый. Если бы электрон был увеличен до размера Солнечной системы, он все равно выглядел бы сферическим в пределах толщины человеческого волоса.
- Масса 9.11×10 -31 кг
- Радиус менее 10 -18 м
- Отклонение от сферы менее 10 -26 м
Состав атома определяет одинаковое количество протонов и электронов, однако он может потерять или приобрести электрон(ы) становится «несбалансированным». Неуравновешенный атом называется ионом; если он получает электрон (таким образом, имея их больше, чем протонов), он становится отрицательно заряженным ионом или анионом. Если происходит обратное, и атом теряет электрон, он становится положительно заряженный ион или катион. Ионы могут соединяться с другими ионами, создавая большое разнообразие различных смесей.
Один из способов, при котором состав атомов получает или теряет электроны, — это излучение высокой энергии. Это излучение вызывает образование ионов и в результате называется ионизирующим излучением.
Электроны и электричество
Электричество — это поток электронов через проводник, обычно в виде проволоки, этот поток называется электрическим током.
Чтобы этот поток произошел, электроны должны разорвать свою атомную связь (электричество — это поток электронов, а не их поток с ядрами, с которыми они связаны). Разрыв атомной связи между электроном и его ядром требует ввода энергии, которая заставляет электрон преодолевать электромагнитную силу, сдерживающую его, и таким образом свободно течь.
Проводящий материал
Все формы материи содержат электроны, однако в некоторых материалах они более свободно связаны с их ядрами. Эти материалы (известные как проводники или металлы) требуют очень мало энергии для создания электрического тока, потому что слабо связанные электроны требуют гораздо меньше энергии для преодоления электромагнитной силы, удерживающей их на месте.
Что генерирует поток электронов?
Поток электронов можно генерировать различными способами, но основные из них следующие:
- Электрические генераторы — это устройства, использующие принцип электромагнитной индукции. Электромагнитная индукция это процесс перемещения проводника через магнитное поле с целью создания электронного потока. Требуется только относительное движение проводника и магнитного поля, что означает, что магнитное поле может двигаться, пока проводник неподвижен. Когда электроны в проводнике проходят через магнитное поле (если поле достаточно сильное, а относительная скорость проводников через поле достаточно быстрая), то связи с их ядрами будут разорваны и будет индуцирован поток. Для того чтобы вызвать высокий уровень электронного потока, необходимо большое количество энергии для создания относительной скорости между проводником и магнитами.
- Химические реакции внутри батарей также создают электродвижущую силу, заставляющую электроны течь по цепи.
- Фотоны (энергия света) также могут вызывать поток электронов, когда они сталкиваются с фотоэлектрической ячейкой расположенной в солнечной панели.
Таким образом, структура или состав атома определяет принадлежность к тому или иному химическому элементу.
Задача 1
Взяли две пары маленьких незаряженных шариков. В первой паре от атомов одного шарика «оторвали» 100 электронов и «посадили» их на второй шарик. Во второй паре то же самое сделали с тысячей электронов. Потом шарики в каждой паре разнесли на одно и то же довольно большое расстояние. (Пары далеко друг от друга, гораздо дальше, чем шарики в каждой паре.) Будут ли шарики каждой пары притягиваться или отталкиваться? В какой паре сила их взаимодействия больше и во сколько раз?
Шарики каждой пары притягиваются, во второй паре притяжение сильнее в 100 раз. Действительно, во втором случае «без электрона» осталось 1000 протонов, в 10 раз больше, чем в первом. Они притягивают каждый «убежавший» электрон в 10 раз сильнее. Но и «убежавших» электронов во втором случае в 10 раз больше! Значит, суммарная действующая на них сила отличается в 100 раз.
Заметим, что остальные, «неразлучённые» протоны и электроны тоже притягивают или отталкивают каждую заряженную частицу, но их действие скомпенсировано: с какой силой протон притягивает, с такой же электрон рядом с ним отталкивает, или наоборот.
Электрическое притяжение к протонам и держит электроны в атоме, не даёт им улететь. Как мы вскоре убедимся, оно же скрепляет атомы в молекулы. Но не только! Оно же заставляет молекулы одних тел действовать на молекулы других. Если не считать силы гравитационного притяжения, с которой все мы знакомимся с детства (глядя, как падают на пол выпущенные из руки игрушки), все остальные наблюдаемые нами физические явления вызваны как раз электрической силой. Упругость пружины, трение, прилипание разных вещей друг к другу или, наоборот, их взаимное отталкивание — за всё это отвечает взаимодействие электронов одних атомов с ядрами и электронами других.
Но вернёмся к нашим атомам. В нормальной ситуации атом электронейтрален, то есть не имеет заряда: у него электронов столько, сколько протонов в ядре. Если это не так (например, кто-то похитил у атома электрон или атом где-то захватил себе чужой), такой «калечный» атом называется ионом. Тогда он заряжен — положительно, если электронов не хватает, и отрицательно, если есть лишние.

Протоны притягивают к себе электроны и заставляют их вертеться вокруг ядра, не улетая далеко. А нейтроны в электрическом взаимодействии не участвуют. Зачем же они тогда нужны? Затем, чтобы «склеивать» протоны в ядре — ведь протоны отталкиваются друг от друга электрическими силами, и без нейтронов они бы разлетелись в разные стороны! Силы, которыми нейтроны удерживают протоны вместе, — уже не электрические. Они действуют только на очень маленьких расстояниях — внутри ядра 3 .
Теперь можно догадаться, чем отличаются друг от друга разные сорта атомов: у них разное количество электронов. И, соответственно, протонов в ядре. Номер элемента в таблице Менделеева (число, написанное крупно в правом верхнем углу каждой клетки) — это число протонов в атомах этого элемента. А как узнать количество нейтронов? По массе атома, ведь массы протонов и нейтронов равны! Например, в атоме водорода — самом маленьком и самом лёгком — всего один протон. А в ядре атома гелия два протона, и при этом атом гелия в 4 раза тяжелее атома водорода. Электроны не в счёт — значит, в ядре гелия 2 нейтрона!

Масса атома — в единицах массы водорода — написана в каждой клетке внизу 4 . Легко убедиться, что у нетяжёлых атомов нейтронов примерно столько же, сколько протонов. А у тяжёлых — нейтронов больше: всё труднее становится удерживать всю эту громоздкую конструкцию.


Но почему эта масса нецелая? Не может же, например, у хлора быть 18 с половиной нейтронов? Конечно, нет. Просто это значит, что в природе бывают атомы с 17 электронами, 17 протонами и 18 нейтронами, а бывают такие, у которых электронов и протонов столько же, а число нейтронов отличается. И те и другие — атомы хлора, ведь электронов и протонов столько же. Такие «подвиды» атомов одного вида называют изотопами. В таблице Менделеева написана средняя масса атомов каждого вида (с учётом распространённости их изотопов).
В большинстве клеток средняя масса близка к целому числу. Это значит, что, как правило, в природе больше всего какого-то одного изотопа атомов каждого вида, а атомы с другим количеством нейтронов встречаются не так уж часто. Почти всегда можно не обращать на них внимания и округлять массу до ближайшего целого числа.
Когда хотят уточнить, какой именно изотоп имеется в виду, заряд ядра и его массу пишут прямо рядом с названием элемента: например, (<>^_mathrm) — обычный водород; (<>^_mathrm) — тяжёлый водород, он же дейтерий; (<>^_mathrm) — сверхтяжёлый водород, тритий.
Ну-ка, проверим — всё ли понятно?
Задача 2
Сколько у атома (<>^_mathrm) электронов, протонов и нейтронов? А у атома (<>^_mathrm)? А у атома (<>^_mathrm)? У каких атомов 30 нейтронов? (Считаем только основные, самые распространённые изотопы каждого элемента.)
(<>^_mathrm) — 6 электронов, 6 протонов, 6 нейтронов; (<>^_mathrm) — 11 электронов, 11 протонов, 23−11 = 12 нейтронов; (<>^_mathrm) — 79 электронов, 79 протонов, 197−79 = 118 нейтронов; у марганца (<>^_mathrm) и железа (<>^_mathrm).
Задача 3
Если 1 кг воды «расщепить» на кислород и водород, сколько получится граммов газа кислорода?
В молекуле воды на каждый атом кислорода приходится 2 атома водорода. Но в атоме кислорода 8 протонов + 8 нейтронов, он весит в 16:2 = 8 раз больше, чем оба эти атома водорода, вместе взятые (в них ведь всего по одному протону). Значит, на атомы кислорода приходится 8/9 всей массы воды. Когда атомы кислорода «отцепятся» от атомов водорода и «слепятся» по два в молекулы кислорода О2, их суммарная масса останется прежней: 8/9 кг.
Задача 4
Во что превратится атом кислорода (<>^_mathrm), если добавить в его ядро один нейтрон? А если убрать один протон?
Если добавить нейтрон, получится тяжёлый изотоп кислорода, (<>^_mathrm). А вот если убрать один протон, получится 7 протонов в ядре — это уже не кислород, а азот, хотя и тяжёлый его изотоп (<>^_mathrm). Если при этом ни один электрон не улетит, это будет к тому же отрицательно заряженный ион: электронов больше, чем протонов. Впрочем, появление нового или потеря одного из имеющихся электронов случается с атомами гораздо чаще, чем изменение состава ядра.
Задача 5
У хлора два распространённых изотопа. Более редкий из них имеет 20 нейтронов. Во сколько раз изотопов хлора-37 в природе меньше, чем изотопов хлора-35?
Если бы был только изотоп (<>^_mathrm), масса всех атомов составляла бы 35 масс протона (или нейтрона). В среднем, как мы видели из таблицы Менделеева, на каждый атом хлора приходится примерно 35,5, то есть 0,5 «лишних» нейтрона. А в каждом атоме тяжёлого изотопа (<>^_mathrm) два лишних нейтрона. Значит, чтобы в среднем была половина, тяжёлым должен быть каждый четвёртый атом.
(Более аккуратный подсчёт по указанному в таблице значению средней массы, (35,45−35):2 = 0,225, не даёт более точной оценки — ведь есть ещё другие изотопы хлора. Хоть их и совсем мало, но точнее сосчитать они помешают.)
Итак, изотоп (<>^_mathrm) составляет около 1/4 всего имеющегося в природе хлора, а (<>^_mathrm) — остальные 3/4. Поэтому изотопа (<>^_mathrm) в 3 раза меньше.
Контрольная задача
Есть 3 списка: 1) азот, никель, алюминий, железо, медь, гелий; 2) вода, метан, поваренная соль, спирт, сахар, аспирин; 3) дерево, воздух, бумага, нефть, водка, гранит. Что общего в материалах внутри каждого списка и в чём отличие списков друг от друга? По какому принципу собраны эти списки?
В первом списке молекулы состоят из одинаковых атомов (атомов только одного вида); во втором — каждая молекула состоит из разных атомов, но все молекулы одинаковы. В третьем — вещества состоят из смеси молекул разных видов.

Художник Мария Усеинова
1 А разобрались ли вы? Для проверки и чтобы понять, как непросто было до всего этого догадаться, предлагаем вам решить «контрольную задачу» в конце статьи.
2 Вообще-то, когда договаривались, про электроны и протоны ещё ничего не знали — это было лет за 150 до их открытия. Тогда положительным назвали заряд, который получается на стекле, если его потереть шёлковой тряпочкой. Теперь мы знаем, что электроны со стекла «убегают» на шёлк.
3 Зато на этих маленьких расстояниях они очень большие — надо ведь «победить» электрическое отталкивание! Поэтому они так и называются — «сильные силы» (strong force), сильное взаимодействие.
4 Тут мы чуть-чуть обманываем читателя, но это не беда: дальше придётся обманывать ещё сильнее.