а том, атома, муж. (греч. atomos, букв. неделимый). Мельчайшая частица материи (в атомистической теории предполагалась неделимой; ест.). Молекула воды состоит из двух атомов водорода и одного атома кислорода.
| перен. Ничтожная величина, одна из многих незначительных частей какого-нибудь целого (книж.).
«Толковый словарь русского языка», впервые изданный в 1930-х годах прошлого века под редакцией Д.Н. Ушакова, и по сей день является одним из самых известных и подробных толковых словарей русского языка. Его популярность можно сравнивать разве что с популярностью словаря Ожегова.
Словарь был подготовлен в рамках реализации государственного заказа на унификацию норм русского литературного языка, испытавшего серьезные изменения в начале прошлого столетия. Всего словарь содержит 4 тома, в которых представлено более 90 тысяч словарных статей. В работе над составлением словаря принимали участие крупные ученые того времени. Словарь рассчитан на читателей практически всех возрастов.
Термины атомной энергетики
наименьшая частица химического элемента, сохраняющая его свойства. Состоит из ядра с протонами и нейтронами и электронов, движущихся вокруг ядра. Число электронов в атоме равно числу протонов в ядре.
Словарь «Термины атомной энергетики» представляет собой отраслевой научный словарь, содержащий термины по атомной энергетике, применяемые на различных этапах жизненного цикла атомного энергетического объекта: научно-исследовательская и опытно-конструкторская работа, проектирование, строительство, оборудование, монтаж, пусконаладка и эксплуатация. В словарь включены как классические термины, так и новые, возникшие в недавнее время в связи с развитием атомно-энергетической отрасли, в том числе включая реакторостроение, ядерную физику, химию (водоочистку и водно-химический режим), антирадиационную защиту и охрану окружающей среды.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
Что такое атом ?
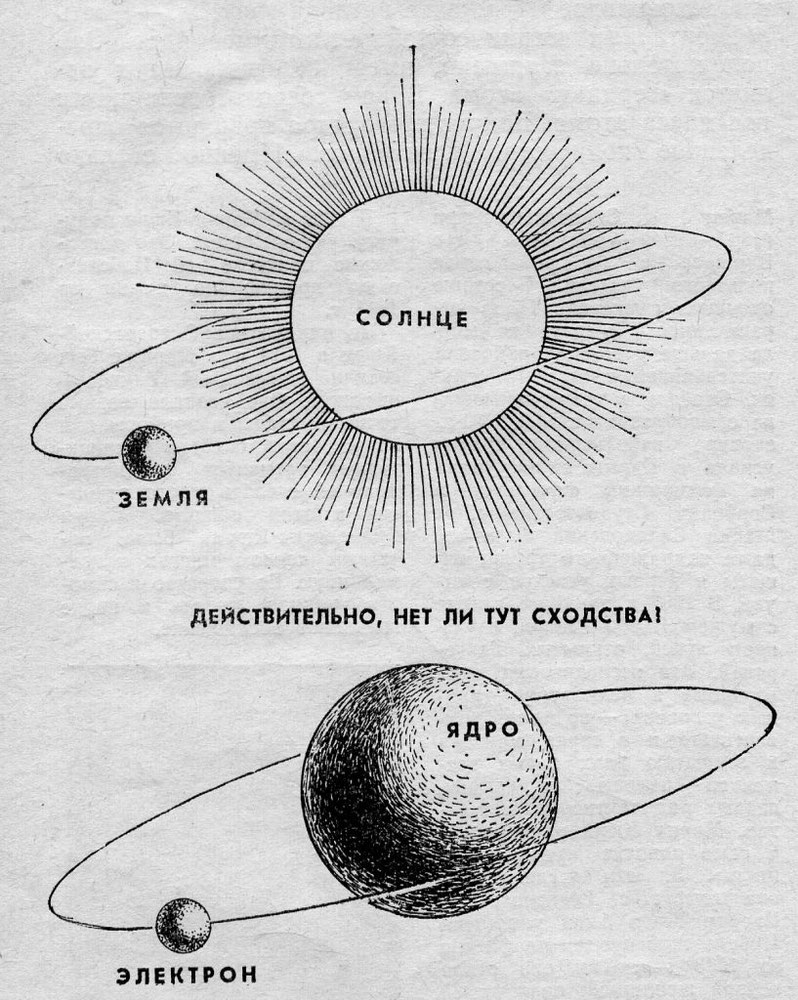
Современные представления о строении атома продвинулись далеко. Ядро атома, в свою очередь, состоит субатомных частиц, или нуклонов – протонов и нейтронов. Именно нуклоны составляют основную массу атома. При этом протоны и нейтроны также не являются неделимыми частицами, и состоят из фундаментальных частиц — кварков.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
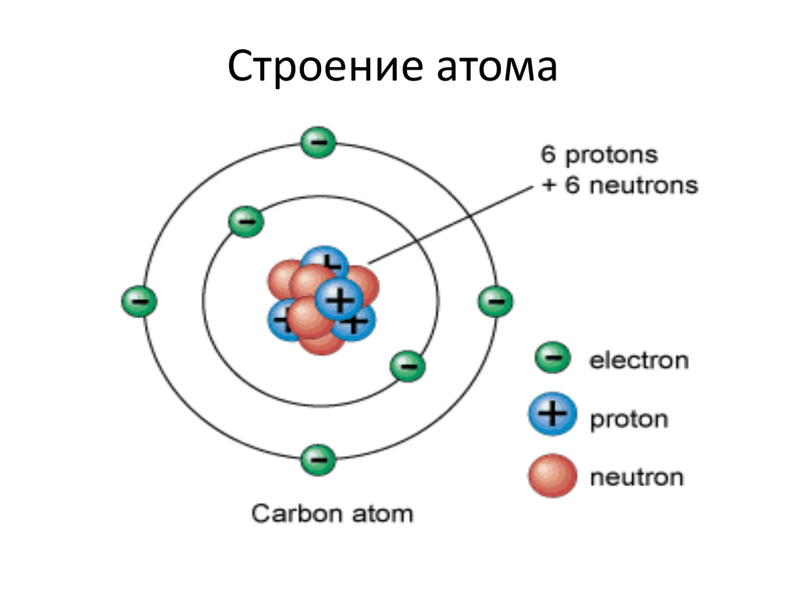
Ниже приведем элементарную схему строения атома углерода.
Свойства атомов
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие «моль». 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
(№ элемента = p = Z = ē)
Число нейтронов = массовое число – порядковый номер
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями). Нумерация слоев начинается с ближайшего к ядру электронного слоя.
- На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.
- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.

На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атом
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.

Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
Проскок электрона
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d 9 4s 2 . Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d 10 4s 11

| Итог: иметь конфигурации nd 5 и nd 10 более энергетически выгодно, чем nd 4 и nd 9 . Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний. |
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.
У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
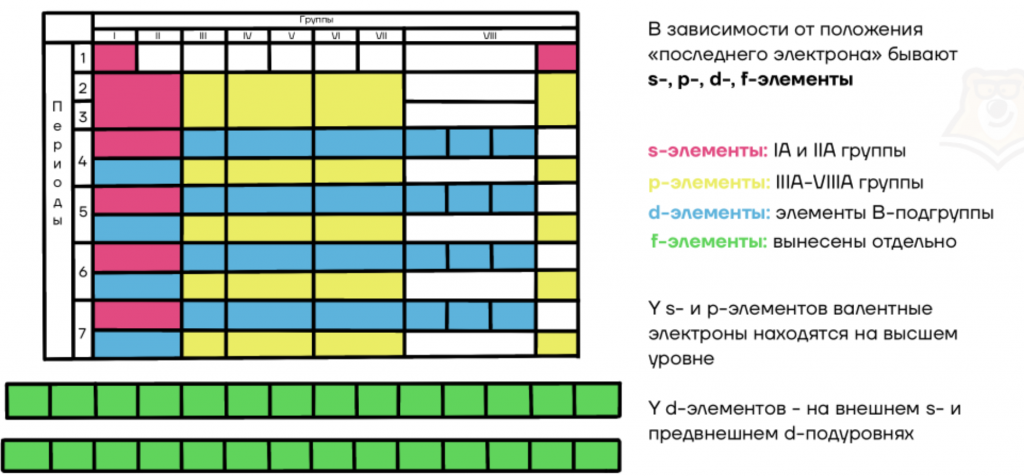
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.
Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
АТОМ
(от греч. atomos — неделимый) частица вещества микроскопических размеров и очень малой массы (микрочастица), наименьшая часть химического элемен. смотреть
атом м. 1) Мельчайшая электрически нейтральная частица химического элемента, являющаяся носителем его свойств. 2) перен. разг. Атомная энергия.
АТОМ
атом См. малость. Словарь русских синонимов и сходных по смыслу выражений.- под. ред. Н. Абрамова, М.: Русские словари,1999. атом малость, частица, акцептор, микрочастица Словарь русских синонимов. атом сущ., кол-во синонимов: 5 • адатом (1) • акцептор (2) • мезоатом (1) • микрочастица (4) • частица (128) Словарь синонимов ASIS.В.Н. Тришин.2013. . Синонимы: адатом, акцептор, мезоатом, микрочастица, частица. смотреть
АТОМ (от греч. atomos — неделимый), частица вещества микроскопич. размеров и очень малой массы (м и к р о ч а с т и ц а), наименьшая часть хим. элеме. смотреть
Атомное строение веществ
Первые представления об атомах как мельчайших, далее неделимых частицах веществ появились у философов Древней Греции еще за 400 лет до н. э. Они считали, что каждое вещество составлено из присущих только ему атомов, т. е. существуют атомы, например, мяса, песка, дерева, воды и т. д. Другими словами, сколько есть веществ, столько и видов атомов.
Доказательств существования атомов в то время, конечно, не было, и это учение было забыто почти на две тысячи лет. И только в самом начале XIX в. идея атомного строения веществ была возрождена английским ученым Дж. Дальтоном.
Согласно его теории все вещества состоят из очень маленьких частиц — атомов. В процессе химических превращений атомы не разрушаются и не возникают вновь, а только переходят из одних веществ в другие. Они являются как бы деталями конструктора, из которых можно собирать всевозможные изделия.
Атомы — мельчайшие, химически неделимые частицы.
Химические элементы
Общее число атомов во Вселенной невообразимо велико. Однако видов атомов сравнительно немного. Каждый такой определенный вид атомов называется химическим элементом.
Химический элемент — определенный вид атомов.
Позже, после изучения строения атома, вы узнаете более точное определение этого понятия.
Всего в настоящее время известно 118 химических элементов. Атомы одного и того же элемента имеют одинаковые размеры, практически одинаковое строение и массу. Атомы разных элементов различаются между собой, прежде всего, строением, размерами, массой и целым рядом других характеристик.
На заметку: Из 118 химических элементов в природе встречается только 92, а остальные 26 получены искусственно с помощью специальных физических методов.
Из атомов такого небольшого числа химических элементов построены все вещества, существующие в природе и полученные химиками в лабораториях. А это более 60 млн веществ. Все они представляют собой самые различные сочетания атомов тех или иных элементов. Так же, как из 33 букв алфавита составлены все слова русского языка, из атомов относительно небольшого числа элементов состоят все известные вещества.
Атом
Вещества состоят из атомов. Атом — частица вещества очень малых размеров и массы . Это самая маленькая часть химического элемента, которая является носителем его свойств.
Слово «атом» происходит от греческого атород — «неделимый», и таковой эта частица считалась долгие века. Однако уже в начале XX в. стала известна структура атома.
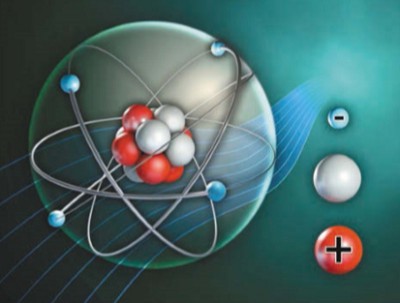
Упрощенная модель атома. Красным цветом обозначены положительно заряженные протоны, серым — нейтральные нейтроны, голубым — отрицательно заряженные электроны.
Атом состоит из атомного ядра и электронной оболочки. Сто лет назад считалось, что электроны вращаются вокруг ядра, как планеты вокруг Солнца. Так часто изображают атом для упрощения. На самом деле невозможно определить точку, где в данный момент находится электрон. Электрон заряжен отрицательно, а ядро — положительно. Само ядро также состоит из элементарных частиц — протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны электрически нейтральны. Обычно атом нейтрален. Это справедливо, когда число протонов в ядре такое же, как число электронов. Если у атома на внешней орбите имеется один или несколько дополнительных электронов, он превращается в отрицательно заряженный ион (анион). Если у атома на внешней орбите недостает одного или нескольких электронов, он превращается в положительно заряженный ион (катион). Таких ионов очень много в различных растворах.
Более 99% массы атома сосредоточено в ядре. На долю электронов приходится очень незначительная часть. Массу атома измеряют в атомных единицах массы, равных 1/12 массы атома стабильного изотопа углерода 12С.
Имеются атомы с одинаковым числом протонов, но с разным числом нейтронов.
Такие атомы называются изотопами (разновидностями) одного и того же элемента. Существует единственный из стабильных атомов, у которого в ядре вообще нет нейтронов, а имеется только один протон. Вокруг ядра вращается (точнее, создает оболочку) один электрон. Это легкий водород, или протий. Существует также тяжелый водород — дейтерий. У него в ядре имеются две частицы — протон и нейтрон. Есть еще и сверхтяжелый водород — тритий. У него в ядре имеются три частицы — один протон и два нейтрона. А электрон у всех этих изотопов один. Вода, образованная дейтерием, называется тяжелой водой.
Атомы образуют межатомные связи и формируют молекулы. Молекулы могут состоять как из одного вида атомов, так и из нескольких.

Атом водорода Н, состоящий из одного протона и одного электрона
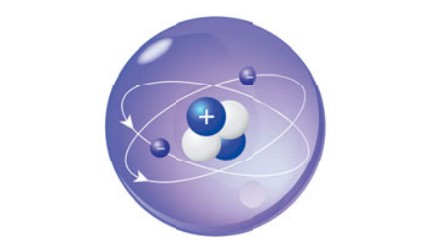
Атом гелия: его ядро состоит из двух протонов и двух нейтронов и окружено двумя электронами
Атом




(греч. atomos – неделимый) – мельчайшая частица химического элемента, сохраняющая его свойства; в центре атома – заряженное ядро, в котором содержится почти вся масса атома; вокруг движутся электроны, образующие электронные оболочки, размеры которых 10–10 м определяют размер атома.
Поделиться
- Telegram
- Вконтакте
- Одноклассники