Что меньше: атом или электрон? Эту вопрос задают себе многие люди, интересующиеся физикой и химией. Чтобы разобраться в этом, нужно узнать, что такое атом и электрон. Атом — это наименьшая частица вещества, которая обладает химическими свойствами. Он состоит из ядра и электронов, которые движутся вокруг ядра. Электрон — это элементарная частица, которая находится вокруг ядра атома. Итак, если сравнивать размеры атома и электрона, то можно сказать, что атом гораздо больше электрона. Однако, точные размеры и формы атомов и электронов зависят от конкретного элемента и его состояния. Все это делает науку о микромире еще более увлекательной и загадочной.
Чтобы разобраться в этом вопросе, давайте сначала рассмотрим, что представляют собой атом и электрон.
Атом — это основная строительная единица вещества. Он состоит из трех основных частиц: протонов, нейтронов и электронов. Протоны и нейтроны находятся в центре атома, в его ядре, а электроны вращаются вокруг ядра по определенным орбитам.
Электрон — это элементарная заряженная частица, которая обладает отрицательным электрическим зарядом. Он находится вне ядра атома и вращается по своим орбитам.
Теперь, отвечая на вопрос: атом или электрон — что меньше, я могу сказать, что электрон меньше. Электрон — это элементарная частица, имеющая очень малую массу и размеры порядка 10^-15 метра.
С другой стороны, атом намного крупнее электрона. Он имеет массу, состоящую из протонов и нейтронов в ядре, и размеры порядка 10^-10 метра. Таким образом, атом является значительно больше по размеру и массе, чем электрон.
Также стоит отметить, что в атоме может находиться разное количество электронов в зависимости от его химических свойств. Число электронов в атоме определяет его заряд и его способность взаимодействовать с другими атомами.
- Атом — основная строительная единица вещества.
- Электрон — элементарная заряженная частица.
- Электрон меньше атома по размеру и массе.
- Атом крупнее и имеет большую массу по сравнению с электроном.
Существует множество ответов на эти вопросы, и исследования в области физики и химии продолжают расширять наше понимание о микромире. Но одно можно сказать с уверенностью: атомы и электроны — это основа для понимания структуры материи и ее свойств. Они определяют химические реакции, электрические свойства вещества и многое другое.
Так что следующий раз, когда вы задумываетесь над вопросом «Атом и электрон: что меньше?», помните, что электрон — это маленькая частица, которая играет огромную роль, и атом — это более крупная и сложная система, состоящая из множества электронов и других частиц. Оба они важны и необходимы для изучения и понимания мира вокруг нас.
Структура атома
В центре атома находится ядро, которое состоит из протонов и нейтронов. Протоны имеют положительный электрический заряд, а нейтроны являются нейтральными, то есть не имеют заряда. Протоны и нейтроны существуют в ядре в виде связанных частиц и обеспечивают стабильность атома.
Мы меньше Атомов #Shorts
Вокруг ядра находятся электроны, которые обращаются по определенным орбитам, называемым энергетическими уровнями или электронными оболочками. Электроны имеют отрицательный электрический заряд, который компенсирует положительный заряд протонов в ядре, делая атом электрически нейтральным.
Основным атомным номером атома является количество протонов в ядре. Например, у атома кислорода атомный номер 8, что означает наличие 8 протонов в ядре. Количество электронов в атоме также равно количеству протонов, чтобы поддерживать электрическую нейтральность.
Теперь, когда мы понимаем основную структуру атома, давайте ответим на вопрос: «Что меньше: атом или электрон?». Ответ: атом больше, чем электрон. Атом содержит ядро и электроны, а электрон — это одна из частиц, которые обращаются вокруг ядра.
Итак, структура атома включает в себя ядро, состоящее из протонов и нейтронов, а также электроны, которые обращаются по энергетическим уровням. Эти частицы взаимодействуют между собой и образуют различные элементы, которые составляют все вещество в нашей вселенной. Удивительно, не правда ли?
Атом
Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра, имеющего положительный электрический заряд, и отрицательно заряженных электронов. Заряд ядра любого химического элемента равен произведению Z на e, где Z — порядковый номер данного элемента в периодической системе химических элементов, е — величина элементарного электрического заряда.
Электрон — это мельчайшая частица вещества с отрицательным электрическим зарядом е=1,6·10 -19 кулона, принятым за элементарный электрический заряд. Электроны, вращаясь вокруг ядра, располагаются на электронных оболочках К, L, М и т. д. К — оболочка, ближайшая к ядру. Размер атома определяется размером его электронной оболочки. Атом может терять электроны и становиться положительным ионом или присоединять электроны и становиться отрицательным ионом. Заряд иона определяет число потерянных или присоединенных электронов. Процесс превращения нейтрального атома в заряженный ион называется ионизацией.
Атомное ядро (центральная часть атома) состоит из элементарных ядерных частиц — протонов и нейтронов. Радиус ядра примерно в сто тысяч раз меньше радиуса атома. Плотность атомного ядра чрезвычайно велика. Протоны — это стабильные элементарные частицы, имеющие единичный положительный электрический заряд и массу, в 1836 раз большую, чем масса электрона. Протон представляет собой ядро атома самого легкого элемента — водорода. Число протонов в ядре равно Z. Нейтрон — это нейтральная (не имеющая электрического заряда) элементарная частица с массой, очень близкой к массе протона. Поскольку масса ядра складывается из массы протонов и нейтронов, то число нейтронов в ядре атома равно А — Z, где А — массовое число данного изотопа (см. Периодическая система химических элементов). Протон и нейтрон, входящие в состав ядра, называются нуклонами. В ядре нуклоны связаны особыми ядерными силами.
В атомном ядре имеется огромный запас энергии, которая высвобождается при ядерных реакциях. Ядерные реакции возникают при взаимодействии атомных ядер с элементарными частицами или с ядрами других элементов. В результате ядерных реакций образуются новые ядра. Например, нейтрон может переходить в протон. В этом случае из ядра выбрасывается бета-частица, т. е. электрон.
Переход в ядре протона в нейтрон может осуществляться двумя путями: либо из ядра испускается частица с массой, равной массе электрона, но с положительным зарядом, называемая позитроном (позитронный распад), либо ядро захватывает один из электронов с ближайшей к нему К-оболочки (К-захват).
Иногда образовавшееся ядро обладает избытком энергии (находится в возбужденном состоянии) и, переходя в нормальное состояние, выделяет лишнюю энергию в виде электромагнитного излучения с очень малой длиной волны — гамма-излучение. Энергия, выделяющаяся при ядерных реакциях, практически используется в различных отраслях промышленности.


Атом (греч. atomos — неделимый) наименьшая частица химического элемента, обладающая его химическими свойствами. Каждый элемент состоит из атомов определенного вида. В состав атома входят ядро, несущее положительный электрический заряд, и отрицательно заряженные электроны (см.), образующие его электронные оболочки. Величина электрического заряда ядра равна Z-e, где е — элементарный электрический заряд, равный по величине заряду электрона (4,8·10 —10 эл.-ст. ед.), и Z — атомный номер данного элемента в периодической системе химических элементов (см.). Так как неионизированный атом нейтрален, то число электронов, входящих в него, также равно Z. В состав ядра (см. Ядро атомное) входят нуклоны, элементарные частицы с массой, примерно в 1840 раз большей массы электрона (равной 9,1·10 -28 г), протоны (см.), заряженные положительно, и не имеющие заряда нейтроны (см.). Число нуклонов в ядре называется массовым числом и обозначается буквой А. Количество протонов в ядре, равное Z, определяет число входящих в атом электронов, строение электронных оболочек и химические свойства атома. Количество нейтронов в ядре равно А—Z. Изотопами называются разновидности одного и того же элемента, атомы которых отличаются друг от друга массовым числом А, но имеют одинаковые Z. Таким образом, в ядрах атомов различных изотопов одного элемента имеется разное число нейтронов при одинаковом числе протонов. При обозначении изотопов массовое число А записывается сверху от символа элемента, а атомный номер внизу; например, изотопы кислорода обозначаются:
Размеры атома определяются размерами электронных оболочек и составляют для всех Z величину порядка 10 —8 см. Поскольку масса всех электронов атома в несколько тысяч раз меньше массы ядра, масса атома пропорциональна массовому числу. Относительная масса атома данного изотопа определяется по отношению к массе атома изотопа углерода С 12 , принятой за 12 единиц, и называется изотопной массой. Она оказывается близкой к массовому числу соответствующего изотопа. Относительный вес атома химического элемента представляет собой среднее (с учетом относительной распространенности изотопов данного элемента) значение изотопного веса и называется атомным весом (массой).
Атом является микроскопической системой, и его строение и свойства могут быть объяснены лишь при помощи квантовой теории, созданной в основном в 20-е годы 20 века и предназначенной для описания явлений атомного масштаба. Опыты показали, что микрочастицы — электроны, протоны, атомы и т. д.,— кроме корпускулярных, обладают волновыми свойствами, проявляющимися в дифракции и интерференции. В квантовой теории для описания состояния микрообъектов используется некоторое волновое поле, характеризуемое волновой функцией (Ψ-функция). Эта функция определяет вероятности возможных состояний микрообъекта, т. е. характеризует потенциальные возможности проявления тех или иных его свойств. Закон изменения функции Ψ в пространстве и времени (уравнение Шредингера), позволяющий найти эту функцию, играет в квантовой теории ту же роль, что в классической механике законы движения Ньютона. Решение уравнения Шредингера во многих случаях приводит к дискретным возможным состояниям системы. Так, например, в случае атома получается ряд волновых функций для электронов, соответствующих различным (квантованным) значениям энергии. Система энергетических уровней атома, рассчитанная методами квантовой теории, получила блестящее подтверждение в спектроскопии. Переход атома из основного состояния, соответствующего низшему энергетическому уровню Е0, в какое-либо из возбужденных состояний Ei происходит при поглощении определенной порции энергии Еi — Е0. Возбужденный атом переходит в менее возбужденное или основное состояние обычно с испусканием фотона. При этом энергия фотона hv равна разности энергий атома в двух состояниях: hv= Ei— Еk где h — постоянная Планка (6,62·10 —27 эрг·сек), v — частота света.
Кроме атомных спектров, квантовая теория позволила объяснить и другие свойства атомов. В частности, были объяснены валентность, природа химической связи и строение молекул, создана теория периодической системы элементов.
- Анатомический атлас
- Физиология человека
- Детские болезни
- Йога
- Правильное питание
- Как похудеть
- ЛФК (лечебная физкультура)
- Лучшие курорты мира
- Лечение народными средствами
- Лекарственные растения
- Проктология
- Психиатрия
- Алкоголизм
- Курение
- Спортивная медицина
- Судебная медицина
Атомы
На сегодняшний день известно (118) видов атомов. Более (90) из них существуют в природе, а остальные получены искусственно.
Атомы характеризуются:
- определёнными очень малыми размерами;
- определённой, тоже очень малой, массой;
- определённым строением.
Размеры атомов настолько малы, что увидеть их невозможно даже в самый мощный микроскоп. Радиусы атомов составляют (0,046)–(0,25) нм ((1) нм (=) 10 − 9 м). Самый маленький — атом гелия, а самый большой — франция.
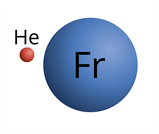
Рис. (1). Атомы гелия и франция
Массы атомов тоже ничтожно малы. Так масса атома водорода составляет всего 1,67 ⋅ 10 − 24 г.
До конца (19)-го столетия атомы считали неделимыми частицами. Но учёные доказали, что атом имеет сложное строение.
Согласно современным представлениям каждый атом состоит из положительно заряженного ядра и движущихся вокруг него электронов . Электроны имеют отрицательный заряд и нейтрализуют положительный заряд ядра.
Ядро намного меньше самого атома. Так, радиус атома водорода составляет (0,046) нм, а радиус его ядра — всего (0,00000065) нм. В его состав входят ещё более мелкие частицы: протоны ((p)) и нейтроны ((n)). Протоны заряжены положительно и определяют заряд ядра. Нейтроны — частицы без заряда.
Заряд протона равен по величине заряду электрона, а число протонов в ядре равно числу электронов в атоме. Поэтому атомы нейтральны.
Атомы различаются между собой строением (числом содержащихся в них частиц), а также массой и размерами.
Рис. (2). Атом гелия
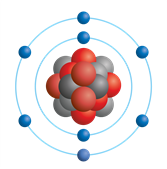
Рис. (3). Атом кислорода
В химических реакциях атомы не изменяются, а только перегруппировываются — объединяются в новых комбинациях.
Атом — мельчайшая химически неделимая электронейтральная частица вещества, состоящая из положительного ядра и отрицательных электронов.
Атомы не изменяются в химических реакциях, но существуют ядерные реакции, при протекании которых их строение изменяется.
Атомы редко встречаются в изолированном виде. Обычно они соединяются друг с другом в молекулы или более крупные структуры. Число вариантов соединения атомов практически бесконечно, и их относительно небольшое число приводит к образованию огромного количества разнообразных веществ.
Почему атомы — величайшее чудо Вселенной

Один из самых удивительных фактов нашего существования был впервые постулирован более 2000 лет назад: на каком-то уровне каждая часть нашей материальной реальности может быть сведена к ряду крошечных компонентов, сохраняющих свои важные индивидуальные характеристики, которые позволяют им собираться воедино и создавать все, что мы видим, знаем, встречаем и переживаем. Эта простая мысль, приписываемая Демокриту Абдерскому, со временем переросла в атомистическое представление о Вселенной.
Хотя буквальное греческое слово «ἄτομος», означающее «неразрезаемый», не совсем применимо к атомам, поскольку они состоят из протонов, нейтронов и электронов, любая попытка «разделить» атом дальше приводит к потере его сущности: того факта, что он является определённым, конкретным элементом таблицы Менделеева. Именно это свойство позволяет ему создавать все те сложные структуры, которые существуют в нашей наблюдаемой реальности: количество протонов, содержащихся в атомном ядре.
Атом настолько мал, что если подсчитать общее количество атомов, содержащихся в одном человеческом теле, то получится около 10 28 : это более чем в миллион раз больше, чем количество звёзд во всей видимой Вселенной. И всё же сам факт того, что мы состоим из атомов, является, пожалуй, величайшим чудом во всей Вселенной.
В атоме, молекуле или ионе переход электронов с более высокого энергетического уровня на более низкий приводит к испусканию излучения с совершенно определённой длиной волны, определяемой фундаментальными константами. Если эти константы изменятся, то изменятся и свойства атомов во всей Вселенной.
Простой факт: именно скромный атом лежит в основе всего известного нам вещества во Вселенной — от обычного газообразного водорода до человека, планет, звёзд и т.д. Все, что состоит из обычной материи в нашей Вселенной — твёрдое, жидкое или газообразное — состоит из атомов. Даже плазма, возникающая в условиях очень высоких энергий или в разреженных глубинах межгалактического пространства, — это просто атомы, лишённые одного или нескольких электронов. Атомы сами по себе очень простые образования, но даже при таких простых свойствах они могут собираться в сложные комбинации, которые просто поражают воображение.
Поведение атомов поистине удивительно. Рассмотрим следующие факты:

- Они состоят из небольшого массивного положительно заряженного ядра, вокруг которого вращается большое маломассивное рассеянное облако отрицательно заряженных электронов.
- При приближении друг к другу атомы поляризуются и притягиваются, в результате чего они либо обмениваются электронами (ковалентно), либо один атом отбирает у другого один или несколько электронов (ионно).
- Когда несколько атомов связываются друг с другом, они могут образовывать молекулы (ковалентно) или соли (ионно), которые могут быть как простыми, состоящими всего из двух атомов, так и сложными, состоящими из нескольких миллионов атомов.
Молекулы — примеры частиц вещества, связанных в сложные конфигурации, — приобретают такие формы и структуры в основном благодаря электромагнитным силам, существующим между входящими в их состав атомами и электронами. Разнообразие доступных структур практически безгранично.
Существует два ключа к пониманию того, как взаимодействуют атомы.

- Каждый атом состоит из электрически заряженных компонентов: положительно заряженного ядра и ряда отрицательно заряженных электронов. Даже когда заряды статичны, они создают электрические поля, а когда заряды находятся в движении, они создают магнитные поля. В результате каждый существующий атом может стать электрически поляризованным при попадании в электрическое поле, а каждый существующий атом может стать намагниченным при воздействии магнитного поля.
- Электроны, вращающиеся вокруг атома, будут занимать самый низкий доступный энергетический уровень. Хотя электрон может находиться в любой точке пространства в пределах примерно 0,1 нанометра от атомного ядра, он может занимать только определённый набор значений энергии, диктуемый правилами квантовой механики. Распределения вероятности нахождения электронов в зависимости от энергетического уровня также определяются правилами квантовой механики и подчиняются определённому распределению вероятности, которое однозначно вычисляется для каждого типа атомов с любым произвольным числом связанных с ними электронов.
Уровни энергии и волновые функции электронов, соответствующие различным состояниям в атоме водорода (хотя эти конфигурации чрезвычайно похожи у всех атомов). Уровни энергии квантованы в кратных значениях постоянной Планка, но размеры орбиталей и атомов определяются энергией основного состояния и массой электрона. В силу принципа исключения Паули на каждом из этих энергетических уровней могут находиться только два электрона, с одним верхним и одним нижним спином, в то время как другие электроны должны занимать более высокие и объёмные орбитали. При переходе с более высокого энергетического уровня на более низкий необходимо изменить тип орбитали, на которой находится электрон, если он собирается испустить только один фотон, иначе он нарушит определённые законы сохранения.
В очень хорошем приближении наше представление о материи во Вселенной, заключающиеся в том, что она состоит из атомов с тяжёлым, положительно заряженным ядром и лёгкими, отрицательными зарядами вокруг него, которые поляризуются в ответ на электрические поля и намагничиваются в ответ на магнитные поля, которые могут обмениваться (ионно) или делиться (ковалентно) электронами с другими атомами, образуя связи, вызывая поляризацию и намагничивание и воздействуя на другие атомы вокруг себя, может объяснить практически всё в нашей привычной, повседневной жизни.
Атомы соединяются друг с другом, образуя молекулы: связанные состояния атомов, которые складываются в почти бесчисленное множество конфигураций и могут взаимодействовать друг с другом самыми разнообразными способами. Соедините вместе большое количество аминокислот — и вы получите белок, способный выполнять ряд важных биохимических функций. Добавьте к белку ион — и вы получите фермент, способный изменять структуру связей в различных молекулах.
А если выстроить цепочку нуклеиновых кислот в правильном порядке, то можно закодировать как создание произвольного количества белков и ферментов, так и создание копий самого себя. При правильной конфигурации собранный набор атомов будет составлять живой организм.

Хотя человек состоит из клеток, на более фундаментальном уровне мы состоим из атомов. Всего в человеческом теле насчитывается около ~10 28 атомов, по количеству в нас больше всего водорода, а по массе — кислорода и углерода.
Если бы всё человеческие знания когда-нибудь были уничтожены в результате грандиозного апокалипсиса, но остались бы выжившие разумные люди, то простая передача им знаний об атомах помогла бы им не только разобраться в окружающем мире, но и начать путь к восстановлению законов физики и всего комплекса поведения материи.
Знание об атомах очень быстро приведёт к реконструкции периодической таблицы. Понимание того, что в микроскопическом мире есть, на что посмотреть, привело к открытию клеток, органелл, а затем и молекул и их атомных составляющих. Химические реакции между молекулами и связанные с ними изменения конфигураций привели к открытию как способов хранения энергии, так и способов её высвобождения, как биологических, так и неорганических.
То, на что у человеческой цивилизации ушли сотни тысяч лет, может быть открыто за одну человеческую жизнь, и это даст увлекательные намёки на будущее, когда будут открыты такие свойства, как радиоактивность или возможности взаимодействия света и материи.

Периодическая таблица элементов отсортирована таким образом (по периодам, напоминающим строки, и группам, напоминающим столбцы) из-за количества свободных/занятых валентных электронов, что является фактором номер один, определяющим химические свойства каждого атома. Атомы могут соединяться в молекулы в огромном количестве, но именно электронная структура каждого из них в первую очередь определяет, какие конфигурации возможны, вероятны и энергетически благоприятны. До 2003 г. висмут считался самым тяжёлым стабильным элементом, а сегодня мы знаем, что он нестабилен по своей природе.
Но атом — это ещё и достаточный ключ к выходу за рамки дальтоновского представления о мире. Открытие того, что атомы могут иметь разную массу, но при этом сохранять свои элементарные свойства, привело бы не только к открытию изотопов, но и помогло бы исследователям обнаружить, что атомные ядра состоят из двух различных типов частиц: протонов (с положительным зарядом) и (незаряжённых) нейтронов.
Это более глубокое открытие, чем может показаться на первый взгляд. Внутри атомного ядра существуют два типа составных частиц с почти, но не совсем одинаковыми массами, причём более лёгкая имеет положительный заряд, а более тяжёлая – нейтральный. Вокруг всего ядра вращаются электроны — частицы, имеющие одинаковый с протоном заряд и меньшую массу, чем разница масс протона и нейтрона внутри ядра.
Если взять свободный протон, то он будет стабилен. Если взять свободный электрон, то он тоже будет стабильным. А если взять свободный нейтрон, то он не будет стабильным, а распадётся на протон, электрон и (возможно) третью, нейтральную частицу.

Схематическая иллюстрация ядерного бета-распада в массивном атомном ядре. Бета-распад — это распад, протекающий через слабые взаимодействия с превращением нейтрона в протон, электрон и антиэлектронное нейтрино. Среднее время жизни свободного нейтрона составляет около 15 минут, но связанные нейтроны могут быть стабильными до тех пор, пока мы их измеряем.
Это небольшое осознание, внезапно пришедшее в голову, могло бы научить вас огромному количеству знаний о фундаментальной природе реальности.
Во-первых, оно сразу же подскажет вам, что между протонами и/или нейтронами должно существовать какое-то дополнительное взаимодействие, отличное от электромагнитной. Например, существование дейтерия (изотопа водорода с 1 протоном и 1 нейтроном) говорит нам о том, что между протонами и нейтронами существует некая сила притяжения, которую нельзя объяснить ни электромагнетизмом (поскольку нейтроны нейтральны), ни гравитацией (поскольку гравитационные силы слишком слабы, чтобы объяснить такое связывание). Должна существовать какая-то ядерная сила, связывающая нейтроны.
Эта сила должна, по крайней мере, на некотором небольшом расстоянии преодолевать электростатическое отталкивание между протонами внутри одного атомного ядра: другими словами, она должна быть сильнее, чем даже (достаточно сильная сама по себе) сила отталкивания между двумя протонами. Поскольку стабильных атомных ядер, состоящих только из двух (или более) протонов, не существует, нейтрон должен играть определённую роль в стабильности ядра.
Другими словами, уже одно открытие того, что атомные ядра содержат и протоны, и нейтроны, делает необходимым существование сильного ядерного взаимодействия — или чего-то очень похожего на неё.
Отдельные протоны и нейтроны могут быть «бесцветными» образованиями, но кварки, входящие в их состав, «цветные». Глюоны могут обмениваться не только между отдельными глюонами внутри протона или нейтрона, но и в комбинациях между протонами и нейтронами, что приводит к ядерному связыванию. Однако каждый такой обмен должен подчиняться полному набору квантовых правил.
Кроме того, как только человек обнаружит, что свободный нейтрон может распадаться, или обнаружит радиоактивный бета-распад, или обнаружит, что звёзды питаются за счёт ядерного синтеза в их ядрах, он сразу же сможет сделать вывод о существовании четвёртого фундаментального взаимодействия в дополнение к гравитации, электромагнетизму и сильному ядерному взаимодействию: того, что мы называем слабым ядерным взаимодействием.
Должно существовать взаимодействие, позволяющее взять несколько протонов, слить их вместе, а затем перевести в состояние, менее массивное, чем исходные два протона, где один протон превращается как минимум в нейтрон и позитрон (антиэлектрон), и при этом сохраняются энергия и импульс. Способность превращать один тип частиц в другой, отличающийся от «суммы частей» или от «создания равных количеств материи и антиматерии», — это то, чего нельзя достичь при помощи трёх других взаимодействий. Просто изучая атомы, можно сделать вывод о существовании слабого ядерного взаимодействия.

Наиболее простая и низкоэнергетическая версия протон-протонной цепочки, в которой из исходного водородного топлива получается гелий-4. Отметим, что только при слиянии дейтерия и протона из водорода получается гелий; во всех остальных реакциях либо образуется водород, либо гелий получается из других изотопов гелия.
Для того чтобы существовала Вселенная с большим количеством типов атомов, необходимо, чтобы наша реальность обладала определённым набором свойств.
- Протон и нейтрон должны быть очень близки по массе: настолько близки, что у связанного состояния протона и нейтрона, т.е. у дейтрона масса должна быть меньше, чем у двух протонов по отдельности.
- Электрон должен быть менее массивным, чем разница масс протона и нейтрона, иначе нейтрон был бы абсолютно стабилен.
- Более того, электрон должен быть намного, намного легче протона или нейтрона. Если бы он имел сравнимую массу, то атомы были бы не только намного меньше (вместе со всеми связанными с ними структурами, построенными из атомов), но электрон проводил бы так много времени внутри атомного ядра, что спонтанная реакция слияния протона с электроном с образованием нейтрона была бы быстрой и вероятной, а соседние атомы спонтанно сливались бы друг с другом даже в условиях комнатной температуры. (Мы видим это на примере мюонного водорода, созданного в лаборатории).
- И, наконец, уровни энергии, достигаемые в звёздах, должны быть достаточными для того, чтобы атомные ядра внутри них подверглись ядерному синтезу, но не может быть так, что всё более тяжёлые атомные ядра всегда более стабильны, иначе мы получили бы Вселенную, заполненную сверхтяжёлыми и сверхкрупными атомными ядрами.
Существование Вселенной, богатой разнообразными атомами, но с преобладанием водорода, требует наличия всех этих факторов.

Анатомия очень массивной звезды на протяжении всей её жизни, кульминацией которой является сверхновая типа II (с коллапсом ядра), когда в ядре заканчивается ядерное топливо. На последней стадии термоядерного синтеза, как правило, происходит горение кремния, в результате чего в ядре на короткое время образуется железо и железоподобные элементы, после чего возникает сверхновая. Наиболее массивные сверхновые с коллапсом ядра обычно приводят к образованию чёрных дыр, а менее массивные — только нейтронных звёзд.
Если бы разумное существо из другой Вселенной впервые столкнулось с нами и нашей реальностью, то, возможно, первое, что мы хотели бы донести до него, — это то, что мы состоим из атомов. Что внутри всего, что состоит из материи в этой Вселенной, есть крошечные, маленькие образования — атомы, которые сохраняют основные свойства, присущие только данному виду атомов. Можно варьировать массу ядер внутри этих атомов и получить один и тот же вид атома, но если изменить их заряд, то получится совершенно другой атом. И что все эти атомы вращаются по орбитам с таким количеством отрицательно заряженных электронов, которое необходимо для точного уравновешивания положительного заряда в ядре.
Изучая поведение и взаимодействие этих атомов, мы можем понять практически все молекулярные и макроскопические явления, возникающие на их основе. Рассматривая внутренние компоненты этих атомов и то, как они собираются, мы можем узнать о фундаментальных частицах, силах и взаимодействиях, которые лежат в основе нашей реальности. Если бы существовала только одна информация, которую можно было бы передать выжившей группе людей в постапокалиптическом мире, то, возможно, ни одна информация не была бы столь ценной, как тот факт, что все мы состоим из атомов. В каком-то смысле это самое чудесное свойство из всех, относящихся к нашей Вселенной.
- Научно-популярное
- Физика
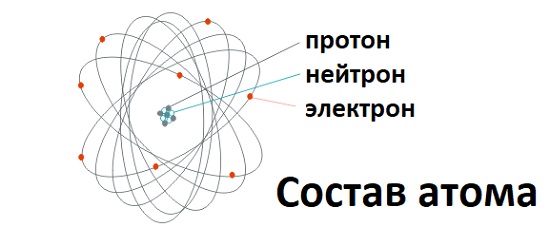
Структура атома
В центре атома находится ядро, которое состоит из протонов и нейтронов. Протоны имеют положительный электрический заряд, а нейтроны являются нейтральными, то есть не имеют заряда. Протоны и нейтроны существуют в ядре в виде связанных частиц и обеспечивают стабильность атома.
Вокруг ядра находятся электроны, которые обращаются по определенным орбитам, называемым энергетическими уровнями или электронными оболочками. Электроны имеют отрицательный электрический заряд, который компенсирует положительный заряд протонов в ядре, делая атом электрически нейтральным.
Основным атомным номером атома является количество протонов в ядре. Например, у атома кислорода атомный номер 8, что означает наличие 8 протонов в ядре. Количество электронов в атоме также равно количеству протонов, чтобы поддерживать электрическую нейтральность.
Теперь, когда мы понимаем основную структуру атома, давайте ответим на вопрос: «Что меньше: атом или электрон?». Ответ: атом больше, чем электрон. Атом содержит ядро и электроны, а электрон — это одна из частиц, которые обращаются вокруг ядра.
Итак, структура атома включает в себя ядро, состоящее из протонов и нейтронов, а также электроны, которые обращаются по энергетическим уровням. Эти частицы взаимодействуют между собой и образуют различные элементы, которые составляют все вещество в нашей вселенной. Удивительно, не правда ли?
Структура электрона
Согласно современной теории квантовой механики, электрон можно представить как некоторую область пространства, в которой существует вероятность его нахождения. Это называется электронной оболочкой или электронной облаком. Внутри электронной оболочки электрон может находиться в различных энергетических состояниях, называемых квантовыми уровнями.
Электронная оболочка состоит из нескольких подобных квантовых уровней, которые обладают различными энергетическими значениями. Они обозначаются буквами s, p, d, f и имеют определенное количество подуровней и максимальное количество электронов, которые могут находиться на каждом уровне. Например, уровень s может содержать не более 2 электронов, а уровень p — не более 6 электронов.
Каждый электрон в атоме имеет свой энергетический уровень и определенные квантовые числа, которые описывают его состояние. Эти числа включают главное квантовое число, орбитальное квантовое число и магнитное квантовое число. Главное квантовое число определяет энергию электрона и его дистанцию от ядра, орбитальное квантовое число определяет форму электронной оболочки, а магнитное квантовое число указывает на ориентацию электрона в пространстве.
Структура электрона и его взаимодействие с другими частицами имеют существенное значение для химических реакций и свойств вещества. Изучение электронной структуры атомов позволяет понять, как образуются химические связи и почему различные элементы обладают разными свойствами.
Итак, структура электрона представляет собой сложную систему квантовых уровней и энергетических состояний, которая определяет его поведение в атоме. Понимание этой структуры позволяет нам лучше понять мир вокруг нас и использовать этот знак для различных целей, таких как разработка новых материалов, лекарств или технологий. Как вы думаете, каково было бы наше понимание мира без электронов и их загадочной структуры?
Что меньше электрон или атом
Строение атома.
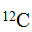
Атом – мельчайшая частица химического элемента, носитель всех его химических свойств. Атом неделим в химическом отношении. Атомы могут существовать как в свободном состоянии, так и в соединении с атомами того же элемента или другого элемента.
За единицу атомных и молекулярных масс в настоящее время приняли 1/12 часть массы атома углерода с атомной массой, равной 12 (изотоп ). Эту единицу называют углеродной единицей.
Масса и размеры атомов. Число Авогадро.
Грамм-атом, так же как и грамм-молекула любого вещества, содержит 6,023•10^23 атомов или соответственно молекул. Это число называется числом Авогадро (N0). Так, в 55,85 г железа, 63,54 г меди, 29,98 г алюминия, и т. п. находится число атомов, равное числу Авогадро.
Зная число Авогадро, нетрудно подсчитать массу одного атома любого элемента. Для этого гpaмм-атомную массу одного атома надо разделить на 6,023•10^23 . Так, масса атома водорода (1) и масса атома углерода (2) соответственно равны:
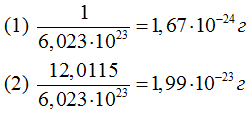
Исходя из числа Авогадро, можно оценить и объем атома. Например, плотность меди равна 8,92 г/см^3, а грамм-атомная масса 63,54 г. Значит, один грамм-атом меди занимает объем 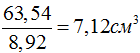 , и на один атом меди приходится объем
, и на один атом меди приходится объем 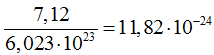 .
.
Структура атомов.
Атом является сложным образованием и состоит из ряда более мелких частиц. Атомы всех элементов состоят из положительно заряженного ядра и электронов — отрицательно заряженных частиц очень малой массы. Ядро занимает ничтожно малую часть всего объема атома. Диаметр атома равен 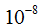 см, а диаметр ядра —
см, а диаметр ядра — 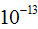 см.
см.
Хотя диаметр ядра атома в 100000 paз меньше диаметра самого атома, практически вся масса атома сосредоточена в его ядре. Отсюда следует, что плотность атомных ядер очень велика. Если бы удалось собрать 1 см3 атомных ядер, то его масса была бы около 116 млн. тонн.
Ядро состоит из протонов и нейтронов. Эти частицы имеют общее название — нуклоны.
Протон — 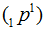 — устойчивая элементарная частица с массой, близкой к углеродной единице. Заряд протона равен заряду электрода, но с обратным знаком. Если заряд электрона принимают равным —1, то заряд протона равен +1. Протон – это атом водорода, лишенный электрона.
— устойчивая элементарная частица с массой, близкой к углеродной единице. Заряд протона равен заряду электрода, но с обратным знаком. Если заряд электрона принимают равным —1, то заряд протона равен +1. Протон – это атом водорода, лишенный электрона.
Нейтрон – атомная оболочка, отрицательный заряд которой компенсирует положительный заряд ядра, обусловленный наличием в нем протонов.
Таким образом, количество электронов в атоме равно количеству протонов в его ядре.
Зависимость между числом протонов , числом нейтронов и массовым числом атома выражается уравнением: N=A-Z
Отсюда число нейтронов в ядре атома любого элемента равно разности между его массовым числом и числом протонов.
Так число нейтронов в ядре атома радия с массой 226 N=A-Z=226-88=138
Масса и заряд электрона.
Все химические процессы образования и разрушения химических соединений происходят без изменения ядер атомов элементов, входящих в состав этих соединений. Изменения претерпевают только электронные оболочки. Химическая энергия, таким образом, связанa с энергией электронов. Чтобы понимать процессы образования и разрушения химических соединений, следует иметь представления о свойствах электрона вообще и особенно о свойствах и поведении электрона в атоме.
Электрон — это элементарная частица, обладающая элементарным отрицательным электрическим зарядом, т. е. наименьшим могущим существовать количеством электричества. Заряд электрона равен 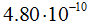 эл. ст. ед. или
эл. ст. ед. или 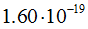 кулона. Масса покоя электрона равна
кулона. Масса покоя электрона равна 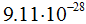 г, т.е. в 1837,14 раза меньше массы атома водорода. Масса электрона составляет
г, т.е. в 1837,14 раза меньше массы атома водорода. Масса электрона составляет 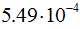 углеродной единицы.
углеродной единицы.
Модель атома по Бору.
В начале XX века М. Планк А. Эйнштейн создали квантовую теорию света, согласно которой свет является потоком отдельных квантов энергии, которую нecyт частицы света — фотоны.
Величина кванта энергии (E) различна для различных излучений и пропорциональна частоте колебаний 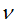 :
: 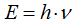 ,
,
где h — постоянная Планка.
М. Планк показал, что атомы поглощают или испускают лучистую энергию только отдельными вполне определенными порциями – квантами.
Пытаясь увязать закон классической механики с квантовой теорией датский ученый Н. Бор считал, что электрон в атоме водорода может находиться лишь на определенных — постоянных орбитах, радиусы которых относятся друг к другу как квадраты целых чисел 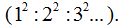 Эти орбиты Н. Бором были названы стационарными.
Эти орбиты Н. Бором были названы стационарными.
Излучение энергии происходит только при переходе электрона с более дальней орбиты на более близкую к ядру орбиту. При переходе же электрона с болей близкой орбиты на более дальнюю энергия атомом поглощается. 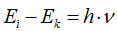 , где
, где 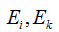 — энергии электронов в стационарных состояниях.
— энергии электронов в стационарных состояниях.
При Ei > Ек энергия выделяется.
При Ei < Ек энергия поглощается.
Решение вопроса о распределении электронов в атоме основано на изучении линейчатых спектров элементов и их химических свойств. Спектр атома водорода почти полностью подтверждал теорию Н. Бора. Однако наблюдаемое расщепление спектральных линий у многоэлектронных атомов и усиление этого расщепления в магнитном и — электрических полях теория Н. Бора объяснить не могла.
Волновые свойства электрона.
Законы классической физики противопоставляют друг другу понятия «частица» и «волна». Современная физическая теория, получившие название квантовой, или волновой механики, показала, что движение и взаимодействие частиц малой массы — микрочастиц происходят по законам, отличным от законов классической механики. Микрочастице одновременно присущи некоторые свойства корпускул (частиц) и некоторые свойства волн. С одной стороны, электрон, протон или другая микрочастица движется и действует подобно корпускуле, например, при соударении с другой микрочастицей. С другой стороны, при движении микрочастицы обнаруживаются типичные для электромагнитных волн явления интерференции и дифракции.
Таким образом, в свойствах электрона (как и других микрочастиц), в законах его движения проявляются неразрывность и взаимосвязь двух качественно различных форм существования материи, вещества и поля. Микрочастицу нельзя рассматривать ни как обыкновенную частицу, ни как обыкновенную волну. Микрочастица обладает корпускулярно-волновым дуализмом.
Говоря о взаимосвязи вещества и поля, можно прийти к выводу, что, если каждой материальной частице присуща определенная масса, то, по-видимому, этой же частице должна отвечать и определенной длины, волна. Возникает, вопрос о взаимосвязи массы и волны. В 1924 году французский физик Луи де Бройль высказал предположение, что с каждым движущимся электроном (и вообще с каждой движущейся материальной частицей) связан волновой процесс, длина волны которого 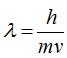 , где
, где 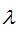 — длина волны в см(м), h — постоянная Планка, равная
— длина волны в см(м), h — постоянная Планка, равная 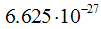 эрг. сек (
эрг. сек (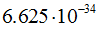 ), m — масса частицы в г (кг),
), m — масса частицы в г (кг), 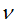 — скорость частицы, в см/сек.
— скорость частицы, в см/сек.
Из этого уравнения видно, что частица, находящаяся в покое, должна иметь бесконечно большую, длину волны и что длина волны уменьшается с увеличением скорости частицы. Длина волны у движущейся частицы большой массы очень мала и экспериментально ее определить пока нельзя. По тому мы говорим о волновых свойствах только микрочастиц. Электрон обладает волновыми свойствами. Это значит, что его движение в атоме можно описать волновым уравнением.
Планетарная модель строения атома водорода, созданная Н. Бором, который исходил из представления об электроне только как классической частице, не может объяснить целого ряда свойств электрона. Квантовая механика показала, что представление о движении электрона вокруг ядра по определенным орбитам подобно движению планет вокруг Солнца, следует считать несостоятельным.
Электрон, обладая свойствами волны, движется по всему объему, образуя электронное облако, которое для электронов, находящихся в одном атоме, может иметь различную форму. плотность этого электронного облака в той или иной части атомного объема неодинакова.
Характеристика электрона четырьмя квантовыми числами.
Основная характеристика, определяющая движение электрона в поле ядра,— это его энергия. Энергия электрона, как и энергия частицы светового потока — фотона, принимает не любые, а лишь определенные дискретные, прерывные или, как говорят, квантующиеся значения.
Движущийся электрон обладает тремя степенями свободы перемещения в пространстве (соответственно трем координатным осям) и одной дополнительной степенью свободы, обусловленной наличием у электрона собственного механического и магнитного моментов, которые учитывают вращение электрона вокруг своей оси. Следовательно, для полной энергетической характеристики состояния электрона в атоме необходимо и достаточно иметь четыре параметра. Эти параметры получили название квантовых чисел. Квантовые числа, так же как и энергия электрона, могут приникать не все, а лишь определенные значения. Соседние значения квантовых чисел различаются на единицу.
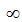
Главное квантовое число n характеризует общий запас энергии электрона или его энергетический уровень. Главное квантовое число может принимать значения целых чисел от 1 до . Для электрона, находящегося в поле ядра главное квантовое число может принимать значения от 1 до 7 (соответственно номеру периода в периодической системе, в котором находится элемент). Энергетические уровни обозначаются или цифрами в соответствии со значениями главного квантового числа, или буквами:
Атом — его состав и структура
Атом — основная единица элементов. Состав атома и его строение определяет различные свойства элементов. Например, состав атома кристалла кремния будет отличаться от структуры, что представляет, например, вещество уран.
Слово «атом» происходит от греческих корней «а»(без) и «том» (вырезать) что означает «неделимый». Вплоть до 20-го века атомы считались минимально возможными частицами.
Ядро является центральным, очень плотным компонентом атома. Оно состоит из протонов и нейтронов (совместно называемых нуклонами) и отвечает за большую часть атомной массы. Протоны и нейтроны удерживаются вместе в ядре так называемым сильным ядерным взаимодействием (которое является самой сильной известной силой во Вселенной). Вокруг ядра находится облако гораздо меньших и более легких электронов, которые притягиваются к ядру электромагнитной силой от взаимодействия с протонами. Различные количества протонов, нейтронов и электронов приводят к тому, что атом обладает различными химическими свойствами, которые определяют, что это за элемент. Атомы невообразимо малы, а их ядра в 1000 раз меньше. На самом деле один кубический сантиметр кремния, содержит приблизительно 5 х 10 22 атома (это 5 с 22 нулями после него!). Это масштабы Вселенной, чтобы увидеть визуальное представление о том, насколько они малы.
Протоны
Протоны — это положительно заряженные частицы, которые находятся внутри ядра атома.
Элемент можно распознать по числу протонов в ядре одного из своих атомов. Кроме того, число протонов определяет место элемента в периодической таблице элементов. Например, состав атома углерода имеет ровно 6 протонов в своем ядре и, таким образом, номер 6 в периодической таблице элементов, торий имеет ровно 90 протонов и, таким образом, номер 90 в периодической таблице элементов.
Протоны отталкиваются друг от друга электромагнитной силой, но стягиваются вместе сильной силой, которая сильнее на коротких расстояниях (эти расстояния составляют около ферми или 10-15 м). Протоны очень маленькие, около 10-15 м в 10 000 раз меньше атома! Несмотря на свои невероятно малые размеры, протоны толкают друг друга с огромной силой, около 100 Н, сравнимой с весом маленькой собаки!
Заряд протона в точности равен и противоположен заряду электрона. Поэтому число электронов в нейтральном атоме всегда равно числу протонов. Протоны состоят из более мелких частиц, называемых кварками, которые также составляют нейтроны.
Число протонов в ядре называется атомным номером, и это число определяет, каким элементом является вещество. Другими словами, изменение числа протонов, изменяет элемент. Это число протонов (атомный номер) изменяется, когда ядро подвергается бета-распаду или альфа-распаду в любой из его различных форм.
Сложность намеренного изменения количества протонов в ядре велика. Вот почему алхимия (средневековая практика превращения свинца в золото) так долго терпит неудачу!
Нейтроны
Нейтроны имеют ту же массу, что и протоны, что делает их легко определяемыми, сколько находятся в составе ядра атома.
Простое вычитание числа протонов из атомной массы атома даст число нейтронов. Например, цезий является номером 55 в периодической таблице элементов и, следовательно, имеет 55 протонов; кроме того, его атомная масса (обычно также найденная в периодической таблице), как известно, составляет 133 (единицы атомной массы). Вычитание 55 из 133 дает 78, то есть число нейтронов в атоме. Один и тот же тип атома (определяемый количеством протонов) может иметь разное количество нейтронов. Они называются различными изотопами атома. Например, углерод-12 является одним изотопом углерода, а углерод-14 — другим изотопом углерода. Имеется общее название составляющих атомного ядра. Нуклон — частица из протона и нейтрона, которые образуют ядро. Нуклиды — совокупность атомов с определенным значением нейтронов и протонов: одинаковое число протонов, но разным числом нейтронов. Нуклоны и нуклиды разные понятия.
Электроны
Электроны — это отрицательно заряженные частицы, которые существуют в облаке вокруг ядра атома. Они невообразимо малы, настолько малы, что квантовая механика необходима для объяснения их специфического поведения, и насколько физика смогла определить, они являются фундаментальной частицей. Лучше всего представить электроны как крошечные частицы, которые» вращаются » вокруг ядра. Их радиус настолько мал, что никто не смог его обнаружить, но он невероятно круглый. Если бы электрон был увеличен до размера Солнечной системы, он все равно выглядел бы сферическим в пределах толщины человеческого волоса.
- Масса 9.11×10 -31 кг
- Радиус менее 10 -18 м
- Отклонение от сферы менее 10 -26 м
Состав атома определяет одинаковое количество протонов и электронов, однако он может потерять или приобрести электрон(ы) становится «несбалансированным». Неуравновешенный атом называется ионом; если он получает электрон (таким образом, имея их больше, чем протонов), он становится отрицательно заряженным ионом или анионом. Если происходит обратное, и атом теряет электрон, он становится положительно заряженный ион или катион. Ионы могут соединяться с другими ионами, создавая большое разнообразие различных смесей.
Один из способов, при котором состав атомов получает или теряет электроны, — это излучение высокой энергии. Это излучение вызывает образование ионов и в результате называется ионизирующим излучением.
Электроны и электричество
Электричество — это поток электронов через проводник, обычно в виде проволоки, этот поток называется электрическим током.
Чтобы этот поток произошел, электроны должны разорвать свою атомную связь (электричество — это поток электронов, а не их поток с ядрами, с которыми они связаны). Разрыв атомной связи между электроном и его ядром требует ввода энергии, которая заставляет электрон преодолевать электромагнитную силу, сдерживающую его, и таким образом свободно течь.
Проводящий материал
Все формы материи содержат электроны, однако в некоторых материалах они более свободно связаны с их ядрами. Эти материалы (известные как проводники или металлы) требуют очень мало энергии для создания электрического тока, потому что слабо связанные электроны требуют гораздо меньше энергии для преодоления электромагнитной силы, удерживающей их на месте.
Что генерирует поток электронов?
Поток электронов можно генерировать различными способами, но основные из них следующие:
- Электрические генераторы — это устройства, использующие принцип электромагнитной индукции. Электромагнитная индукция это процесс перемещения проводника через магнитное поле с целью создания электронного потока. Требуется только относительное движение проводника и магнитного поля, что означает, что магнитное поле может двигаться, пока проводник неподвижен. Когда электроны в проводнике проходят через магнитное поле (если поле достаточно сильное, а относительная скорость проводников через поле достаточно быстрая), то связи с их ядрами будут разорваны и будет индуцирован поток. Для того чтобы вызвать высокий уровень электронного потока, необходимо большое количество энергии для создания относительной скорости между проводником и магнитами.
- Химические реакции внутри батарей также создают электродвижущую силу, заставляющую электроны течь по цепи.
- Фотоны (энергия света) также могут вызывать поток электронов, когда они сталкиваются с фотоэлектрической ячейкой расположенной в солнечной панели.
Таким образом, структура или состав атома определяет принадлежность к тому или иному химическому элементу.